题目内容
【题目】某公司生产出的纯碱产品中经检测只含有氯化钠杂质.为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液.反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示.
求: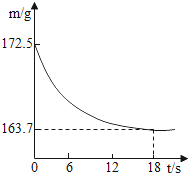
(1)生成CO2的质量.
(2)该纯碱样品中Na2CO3的质量分数.
(3)根据条件,此题还可求算出下列中的(只填字母标号,不计算,可多选).
a.该纯碱样品中NaCl的质量分数;
b.反应所用稀盐酸的溶质质量分数;
c.反应后所得溶液中NaCl的质量分数;
d.反应生成水的质量.
【答案】
(1)
根据质量守恒定律,生成二氧化碳的质量为172.5g﹣163.7g=8.8g
(2)
设:样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
x 8.8g
![]() , x=
, x= ![]() =21.2g,
=21.2g,
则该纯碱样品中碳酸钠的质量分数为 ![]() ×100%=80%,
×100%=80%,
答:该纯碱样品中Na2CO3质量分数为80%.
(3)abcd
【解析】(3)a、利用样品质量与碳酸钠质量差即可求得样品中氯化钠的质量,氯化钠质量与样品质量比可计算样品中氯化钠的质量分数;故a正确;
b、根据反应的化学方程式,由二氧化碳质量可计算稀盐酸中HCl中质量;所加入稀盐酸溶液的质量172.5g﹣26.5g=146g,可以计算出反应所用稀盐酸的溶质质量分数;故b正确;
c、虽然可通过计算确定反应后所得氯化钠溶液中氯化钠的质量,题目说的是烧杯内物质的质量,所得溶液的质量就为163.7g,且其中没有不溶解于水的杂质存在.所以可以计算所得溶液的溶质的质量分数;故c正确;
d、根据反应的化学方程式,由生成二氧化碳的质量可计算出生成水的质量;故d正确;
【考点精析】解答此题的关键在于理解质量守恒定律及其应用的相关知识,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏,以及对根据化学反应方程式的计算的理解,了解各物质间质量比=系数×相对分子质量之比.