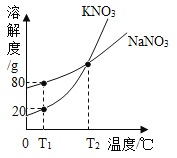
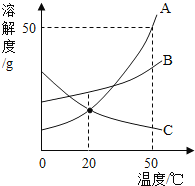
题目内容
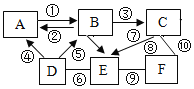
【题目】A﹣F是初中常见的六种物质,它们之间的反应关系如图所示(箭头表示转化关系,短线表示两端的物质能发生化学反应),反应条件、部分反应物和生成物已略去,已知D是地壳中含量最多的一种元素组成的单质,C是世界年产量最高的金属,E是紫红色金属,F是一种盐。请回答下列问题:
(1)写出C的化学式_____。
(2)反应④、⑤利用了D的性质是_____。
(3)标号的反应中属于置换反应的有_____(填序号)。
(4)写出反应②的化学方程式_____。
【答案】Fe 氧化性 ⑧⑨⑩ C+CO2![]() 2CO
2CO
【解析】
根据题目给出的流程图和信息:已知D是地壳中含量最多的一种元素组成的单质,因此D是氧气;C是世界年产量最高的金属,因此C是铁;E是紫红色金属,因此E是铜;F是一种盐;碳和氧气在点燃的条件下充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳和氧气在点燃的条件下生成二氧化碳,二氧化碳和碳在高温的条件下生成一氧化碳,一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,因此A是二氧化碳,B是一氧化碳;⑧铁和硫酸铜溶液反应生成铜和硫酸亚铁;⑨铜和硝酸银溶液反应生成银和硝酸铜,因此F是硝酸银;⑩铁和硝酸银溶液反应生成银和硝酸亚铁,它们都属于置换反应。
(1)C是世界年产量最高的金属,因此C是铁;故答案为:Fe;
(2)反应④、⑤是碳和氧气在点燃的条件下充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,利用了氧气的性质是氧化性;故答案为:氧化性;
(3)⑧铁和硫酸铜溶液反应生成铜和硫酸亚铁;⑨铜和硝酸银溶液反应生成银和硝酸铜;⑩铁和硝酸银溶液反应生成银和硝酸亚铁,它们都属于置换反应;故答案为:⑧⑨⑩;
(4)反应②是二氧化碳和碳在高温的条件下生成一氧化碳,配平即可;故答案为:C+CO2![]() 2CO.
2CO.

【题目】铜镁合金具有优良的导电性,常用作飞机天线等导电材料.欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜合金20g放入烧杯,将280g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下.请计算:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸质量/g | 70 | 70 | 70 | 70 |
剩余固体质量/g | 18.2 | 16.4 | 14.6 | 13.2 |
(1)合金中铜、镁的质量比.
(2)所加稀硫酸的溶质的质量分数.(写出计算过程)
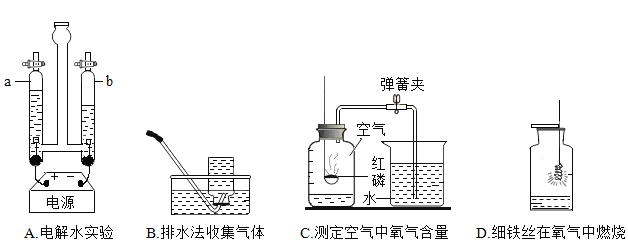
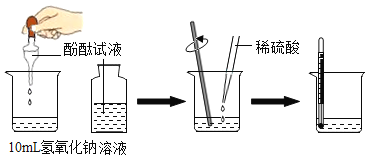
【题目】下列实验中,对应的现象和结论都正确且两者具有因果关系的是( )
实验操作 | 现象 | 结论 | |
A | 常温下,将硫放入空气中 | 剧烈燃烧,发出蓝紫色火焰 | 硫能与氧气反应 |
B | 向某无色溶液中滴入 | 有白色沉淀产生 | 该溶液中一定含有碳酸盐 |
C | 向 | 有气泡产生 | 盐酸易挥发 |
D | 用氯化钠溶液进行导电性试验,观察小灯泡是否变亮 | 小灯泡变亮 | 氯化钠溶液中存在自由移动的离子 |
A.AB.BC.CD.D