题目内容
如图是a、b、c三种物质的溶解度曲线,a与c溶解度曲线相交于P点。据图回答:
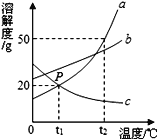
(1)P点的含义是_______。
(2)t1℃时30ga物质加入到50g水中不断搅拌,得到_____g溶液,此时a的质量分数为_______。
(3)t2℃时,a、b、c三种物质的溶解度按由小到大的顺序排列的是_______(填物质序号)。
科学城中学的另一化学兴趣小组用石灰石(含杂质SiO2、CaO,还可能含有少量的Fe2O3)与足量的稀盐酸制备二氧化碳气体,实验结束后对废液中的溶质成分还进行了探究(溶解于水中的气体成分忽略不计)。
(提出问题)废液中的溶质含有哪些物质?
(查阅资料)
①SiO2不溶于水,且不与稀盐酸反应。
②FeCl3溶液遇到硫氰化钾(KSCN)溶液能够很灵敏的显现出红色。
③FeCl3只能在较强的酸性溶液中存在,若pH>3.8时,FeCl3会完全与水发生反应生成Fe(OH)3沉淀。
④已知反应:CaCl2+Na2CO3===CaCO3↓+2NaCl。
(假设猜想)
该小组同学一致认为废液中除含有CaCl2外,还作出以下三种合理的猜想。
猜想1:溶质只有CaCl2
猜想2:溶质有CaCl2和HCl
猜想3:溶质有CaCl2,HCl和FeCl3
请写出猜想3中有FeCl3的依据_______(用化学方程式表示)。
(实验验证)
实验操作 | 实验现象 | 实验结论 |
步骤1:取少量过滤后的废液于试管中, 滴加溶液__________。 | 溶液没有变红 | 废液的溶质中不含FeCl3 |
步骤2:另取少量过滤后的废液于试管中, 加入过量的Na2CO3溶液。 | ____________________ | 猜想2成立 |
(反思评价)
(1)上述步骤2中,小明同学提出可以通过检测废液的pH来判断是否含有HCl。你认为该方案是否合理,其原因是_______。
(2)根据实验结论,实验结束后若要回收CaCl2溶液,正确的操作是:向废液中加入过量的_______,过滤。
除去下列物质中的少量杂质,所选用的试剂及操作方法均正确的是
选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
A | CO2气体(CO) | 过量的氧气 | 点燃 |
B | NaCl(Na2CO3) | 适量的石灰水 | 过滤 |
C | FeSO4溶液(CuSO4) | 足量的锌 | 过滤 |
D | O2(H2O) | 浓硫酸 | 洗气 |
A. A B. B C. C D. D


 和
和 两个粒子核外电子数相同,属于同种元素
两个粒子核外电子数相同,属于同种元素 加热液体 B. 倾
加热液体 B. 倾 倒液体
倒液体 稀释浓硫酸 D.
稀释浓硫酸 D.  检查气密性
检查气密性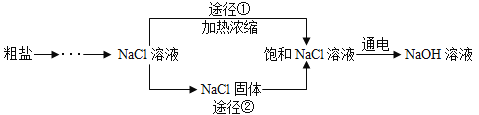
 2NaOH+H2↑+Cl2↑,两电极一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+Cl2↑,两电极一端得到NaOH和H2,另一端得到Cl2。