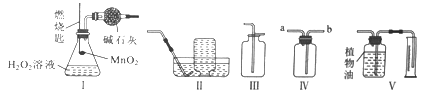
题目内容
【题目】化学反应在防治环境污染中个扮演了重要角色。某工厂废气中国男的SO2,可用以下方式处理。方式一:2SO2+O2+2CaO=2CaSO4;方式二:2SO2+O2+4NaOH=2Na2SO4+2H2O;试计算:(已知:CaSO4的价格为700元/吨)
(1)CaSO4中有两种元素的质量分数呈整数倍关系,这两种元素是硫元素和__________。
(2)若用方式一处理12.8 t SO2,所得产品价值_____元?
(3)若用方式二处理12.8 t SO2,刚好用去100t一定浓度的NaOH溶液,求NaOH溶液的溶质质量分数_________。
【答案】氧元素 19040 16%
【解析】
(1)CaSO4中有两种元素的质量分数呈整数倍关系,为32:(16×4)=1:2,这两种元素是硫元素和氧元素。
(2)解:设若用方式一处理12.8tSO2,生成的硫酸钙的质量为x

x=27.2t
所得产品价值700元/t×27.2t=19040元
答:所得产品价值19040元。
(3)设NaOH溶液中溶质的质量为y。
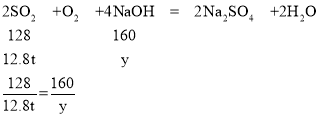
y=16 t
NaOH溶液中溶质的质量分数:![]() ×100%=16%
×100%=16%
答:NaOH溶液的溶质质量分数为16%。

练习册系列答案
相关题目