题目内容
【题目】如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请你回答:

(1)t2时,a、b、c 三种物质溶解度由大到小的顺序__________。
(2)P点的意义________________________。
(3)t2℃时,将30g a物质加入到50g水中充分溶解,所形成溶液是_________(填“饱和”或“不饱和”)溶液,溶液的质量是__________g。
(4)a、b、c饱和溶液从t2降到t1时,所得的溶液的溶质质量分数由大到小顺序是_______________。
(5)如图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的____________(填字母序号)。

A.氢氧化钠固体 B.生石灰固体 C.冰块
D.硝酸铵固体 E.浓硫酸
【答案】 a>b>c t1℃时,a、c的溶解度相同 饱和 75 b > a > c C D
【解析】(1)从t2℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小顺序是:a>b>c;
(2)P点是ac两条线的交点,表示t1℃时,a、c的溶解度相同
(3)t2℃时,a物质的溶解度是50g,即100g水中最多溶解50g,50g水中最多溶解25g,所以t2℃时,将30ga物质加入到50g水中,所得溶液是饱和溶液,且有5ga物质不溶;
(4)a、b的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以将三种饱和溶液分别从t2℃降到t1℃时,a、c析出晶体,溶质的质量分数减小,c的溶解度增大,溶质质量分数与降温前相等,据饱和溶液质量分数的计算式![]() ×100%可知:溶解度越大质量分数也就越大,故所得溶液的溶质质量分数由大到小的顺序为b > a > c;
×100%可知:溶解度越大质量分数也就越大,故所得溶液的溶质质量分数由大到小的顺序为b > a > c;
(5)由于硝酸钾的溶解度随温度的升高而明显增大,硝酸钾的饱和溶液中有晶体析出,说明温度降低了,因此加入的物质应是溶于水吸热的物质.由于氢氧化钠固体、生石灰固体、浓硫酸加入水,都放热,温度升高,均使硝酸钾的溶解度增大,故都不对;加入冰块、硝酸铵固体都能使硝酸钾的溶液的温度降低,使硝酸钾的溶解度减小,试管中有晶体析出。

【题目】根据下图所示实验分析得出的结论中,不正确的是( )
|
|
|
|
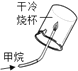
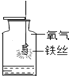
A.甲烷燃烧生成二氧化碳和水 | B.铁能在氧气中燃烧 | C.白磷的着火点比红磷的低 | D.二氧化碳的密度比空气大,不燃烧也不支持燃烧 |
A. A B. B C. C D. D