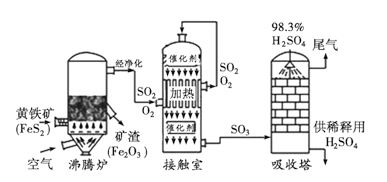
题目内容
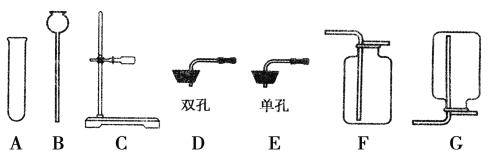
【题目】下列仪器是实验室制取气体常用的,请根据要求完成问题
(1)实验室制取氧气,你选择仪器是__________(填字母,下同),该反应的化学方程式是___________。
(2)实验室制取二氧化碳,你选择的仪器是___________,检验该气体的化学反应方程式________。
(3)实验室制取氢气,你选择的仪器是___________,氢气作为未来理想能源的最大优是__________,实验室制取氢气的化学方程式是______________。
【答案】AC或AE 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
(BC或BE 2H2O2![]() 2H2O + O2↑) BE CO2+Ca(OH)2=CaCO3↓+H2O BC或BD 无污染 Zn+H2SO4=ZnSO4+H2 ↑
2H2O + O2↑) BE CO2+Ca(OH)2=CaCO3↓+H2O BC或BD 无污染 Zn+H2SO4=ZnSO4+H2 ↑
【解析】
(1)A装置的试管口放了一团棉花,是用加热高锰酸钾的方法制取氧气,加热固体制取气体选择发生装置是A,氧气不易溶于水,可用排水法收集,选择收集装置C,氧气的密度比空气的密度大,可用向上排空气法收集,选择收集装置E,该反应的化学方程式是 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑ 。实验室也可用过氧化氢溶液制取氧气,固液常温反应制取气体,选择发生装置B,收集装置选择C或E,过氧化氢制取氧气的化学反应是2H2O2
K2MnO4 + MnO2 + O2↑ 。实验室也可用过氧化氢溶液制取氧气,固液常温反应制取气体,选择发生装置B,收集装置选择C或E,过氧化氢制取氧气的化学反应是2H2O2![]() 2H2O + O2↑ 。
2H2O + O2↑ 。
(2)实验室用石灰石与稀盐酸反应制取二氧化碳,固液常温反应选择发生装置B,二氧化碳易溶于水,不能用排水法收集,二氧化碳的密度比空气的密度大,可用向上排空气法收集,故选BE,检验二氧化碳用澄清石灰水,澄清石灰水的氢氧化钙溶液,该化学反应方程式是CO2+Ca(OH)2=CaCO3↓+H2O
(3)实验室制取氢气,用锌粒与稀硫酸,固液常温反应制取气体选择发生装置B,氢气难溶于水,可用排水法收集,选择收集装置C,氢气的密度比空气的密度小,可用向下排空气法收集,选择收集装置D,故选BC或BD,选择氢气作为未来理想能源的最大优点是燃烧产物只有水,无污染,实验室制取氢气的化学方程式是Zn+H2SO4=ZnSO4+H2 ↑。

【题目】同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应。
(1)实验准备
①查阅资料:
NaHCO3+NaOH=====Na2CO3+H2O NaHCO3+HCl===NaCl+H2O+CO2↑
2NaHCO3![]() Na2CO3+H2O+CO2↑ Na2CO3+CaCl2===CaCO3↓+2NaCl
Na2CO3+H2O+CO2↑ Na2CO3+CaCl2===CaCO3↓+2NaCl
②用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
表中的现象Ⅰ为________________,现象Ⅱ对应反应的化学方程式为__________。
(2)实验过程
(实验1)证明反应生成了Na2CO3同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是________。有同学提出这个实验不足以证明有Na2CO3生成,其理由是_________。为了证明有Na2CO3生成,需要继续进行的操作是_________。
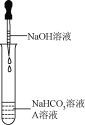
(实验2)证明反应后NaHCO3不存在
同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,该实验方案是_________。
(3)实验反思
通过实验1和实验2说明,对于没有明显现象的化学反应,可以从两个不同的角度证明反应的发生,这两个角度是_______。