题目内容
将25g混有少量的氯化钙的食盐放入173g水里,完全溶解后,加入53g碳酸钠溶液,恰好完全反应,得到沉淀1.00g.计算:(1)食盐中混有氯化钙的质量;______
(2)所用碳酸钠溶液中溶质的质量分数;______
(3)反应后所得溶液中溶质的质量分数.______.
【答案】分析:(1)氯化钙与磷酸钠反应生成碳酸钙沉淀和氯化钠,根据反应的化学方程式,由恰好完全反应生成沉淀碳酸钙的质量可计算反应消耗氯化钙的质量即食盐中混有氯化钙的质量;
(2)根据反应化学方程式,由生成沉淀质量计算消耗碳酸钠的质量,即可求得所用53g碳酸钠溶液中溶质的质量分数;
(3)反应后所得溶液中溶质氯化钠由原混合物中氯化钠及反应生成氯化钠两部分组成,利用质量守恒定律计算出反应后溶液质量,根据反应的化学方程式求出生成氯化钠的质量,运用溶液中溶质质量分数计算公式可求得反应后所得溶液中溶质的质量分数.
解答:解:设恰好完全反应时消耗氯化钙的质量为x,消耗碳酸钠的质量为y,生成氯化钠的质量为z
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
y x 1.00g z
 =
= =
=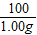 =
=
x=1.11g,y=1.06g,z=1.17g
所用碳酸钠溶液中溶质的质量分数= ×100%=2%
×100%=2%
反应后所得溶液中溶质的质量分数= ×100%≈10%
×100%≈10%
故答案为:
(1)1.11g;(2)2%;(3)约10%.
点评:根据化学方程式能表示反应中各物质的质量比,由反应中某种物质的质量可计算出反应中其它物质的质量.
(2)根据反应化学方程式,由生成沉淀质量计算消耗碳酸钠的质量,即可求得所用53g碳酸钠溶液中溶质的质量分数;
(3)反应后所得溶液中溶质氯化钠由原混合物中氯化钠及反应生成氯化钠两部分组成,利用质量守恒定律计算出反应后溶液质量,根据反应的化学方程式求出生成氯化钠的质量,运用溶液中溶质质量分数计算公式可求得反应后所得溶液中溶质的质量分数.
解答:解:设恰好完全反应时消耗氯化钙的质量为x,消耗碳酸钠的质量为y,生成氯化钠的质量为z
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100 117
y x 1.00g z
 =
= =
=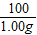 =
=
x=1.11g,y=1.06g,z=1.17g
所用碳酸钠溶液中溶质的质量分数=
 ×100%=2%
×100%=2%反应后所得溶液中溶质的质量分数=
 ×100%≈10%
×100%≈10%故答案为:
(1)1.11g;(2)2%;(3)约10%.
点评:根据化学方程式能表示反应中各物质的质量比,由反应中某种物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目