题目内容
【题目】安徽芜湖轻轨2016年底开工建设,这也标志着,未来芜湖市民将迎来“轻轨生活”,改变出行方式,如图是芜湖轻轨图:
(1)所标部件中,属于金属材料的是(填序号),属于有机合成材料的是(填序号)。
(2)铝的活动性比铁(填“强”或“弱”),请用一个化学方程式表示:。
(3)轻轨的投入使用对环境有什么意义?。
【答案】
(1)①、④;③
(2)强;2Al+3FeSO4=3Fe+Al2(SO4)3
(3)节约资源,保护环境
【解析】(1)图中所示材料中,属于金属材料的是铝合金车身或钢铁轨道,即:①、④;属于有机合成材料的是塑料灯壳,即:③;
(2)铝的活动性比铁强;化学方程式表示为:2Al+3FeSO4=3Fe+Al2(SO4)3 (其他合理也可);
(3)轻轨用电作能源,因此轻轨的投入使用对环境的意义:节约资源,保护环境.
故答案为:(1)①、④;③;(2)强;2Al+3FeSO4=3Fe+Al2(SO4)3;(3)节约资源,保护环境.(1)金属材料包括纯金属与合金,所以铝合金与钢铁属于金属材料;有机合成材料包括塑料、合成纤维和合成橡胶;
(2)铝的活动性比铁强,比较铝和铁的金属活动性,可以采用金属与盐溶液反应的方法,将铝片插入到硫酸亚铁溶液中;
(3)轻轨的投入使用比使用传统能源相比既节约资源,又保护环境.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
(1)【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】为保证实验准确性,实验所用金属片均用砂纸打磨,打磨目的主要是:。
实验⑴为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式为。
从实验现象可判断:金属活动性ZnFe(填“<”、“=”或“>”)。
【得出结论1】
金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是。
(2)实验⑵为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是。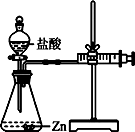
所用药品、实验数据如下表:
实验 | 选用金属 | 盐酸质量分数 | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2 | 2﹣3 | 3﹣4 | 4﹣5 | 前5分 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论2】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是。
(3)【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快原因:再由快到慢的原因是。
(4)【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?
因素1:。
因素2:。




