题目内容
(2012?营口)图1为某钾肥的包装标签,为检测K2SO4含量是否达标,进行如下实验:称取8.0g样品放入烧杯中,加水完全溶解后,再与足量氯化钡溶液充分反应,反应的化学方程式为:K2SO4+BaCl2═BaSO4↓+2KCl(其他物质不参加反应).沉淀质量与所加氯化钡溶液质量的关系如图2所示.根据条件完成下面两个问题:
(1)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?(写计算过程)
(2)两袋该钾肥实际所含钾元素的质量为

(1)通过计算钾肥中硫酸钾的质量分数判断该产品是否符合包装说明?(写计算过程)
(2)两袋该钾肥实际所含钾元素的质量为
39
39
kg.(该空只写结果,保留整数)分析:(1)从图象中看出生成的沉淀的质量是9.32g,根据硫酸钾和氢氧化钡会生成硫酸钡沉淀,利用化学方程式计算出硫酸钾的质量,再算出质量分数与标准比较从而判断是否符合包装说明;
(2)根据(1)中计算出的化肥中硫酸钾的质量分数求出一袋钾肥中硫酸钾的质量,再根据硫酸钾中钾元素的质量分数求出一袋钾肥中钾元素的质量,进而求出两袋钾肥中钾元素的质量.
(2)根据(1)中计算出的化肥中硫酸钾的质量分数求出一袋钾肥中硫酸钾的质量,再根据硫酸钾中钾元素的质量分数求出一袋钾肥中钾元素的质量,进而求出两袋钾肥中钾元素的质量.
解答:(1)解:由图可知,生成的BaSO4质量为9.32g,设8.0g钾肥样品中含有硫酸钾的质量为x,
K2SO4+BaCl2═BaSO4↓+2KCl
174 233
x 9.32g
=
解得x=6.96g
则样品中硫酸钾的质量分数为:
×100%=87%
由于87%>85%,该钾肥中硫酸钾的质量分数符合产品包装说明.
答:该钾肥中硫酸钾的质量分数符合产品包装说明.
(2)一袋该钾肥实际所含硫酸钾的质量为50kg×87%=43.5kg,
两袋该钾肥实际所含硫酸钾的质量为43.5kg×2=87kg,
两袋该钾肥实际所含钾元素的质量为87kg×
=39kg.
故答案为:39kg
K2SO4+BaCl2═BaSO4↓+2KCl
174 233
x 9.32g
| 174 |
| 233 |
| x |
| 9.32g |
解得x=6.96g
则样品中硫酸钾的质量分数为:
| 6.96g |
| 8.0g |
由于87%>85%,该钾肥中硫酸钾的质量分数符合产品包装说明.
答:该钾肥中硫酸钾的质量分数符合产品包装说明.
(2)一袋该钾肥实际所含硫酸钾的质量为50kg×87%=43.5kg,
两袋该钾肥实际所含硫酸钾的质量为43.5kg×2=87kg,
两袋该钾肥实际所含钾元素的质量为87kg×
| 78 |
| 174 |
故答案为:39kg
点评:该题属于标签图象型计算题,主要考查读图能力,注意解题的格式要规范.

练习册系列答案
相关题目
 (2012?营口)图是实验室制取O2的常用装置.据图回答以下问题:
(2012?营口)图是实验室制取O2的常用装置.据图回答以下问题: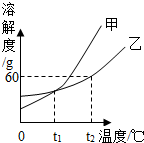 (2012?营口)图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题:
(2012?营口)图所示是甲、乙两种固体物质的溶解度曲线,请回答下列问题: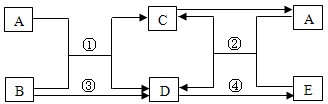 (2012?营口)A、D、E为氧化物,B、C为单质,C为紫红色金属.在一定条件下,他们的转化关系如图所示.请回答下列问题:
(2012?营口)A、D、E为氧化物,B、C为单质,C为紫红色金属.在一定条件下,他们的转化关系如图所示.请回答下列问题: