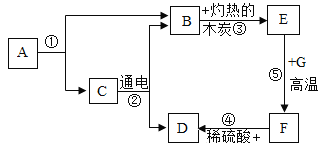
题目内容
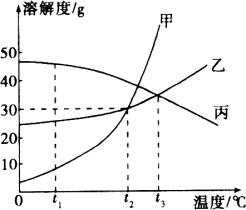
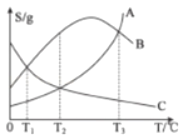
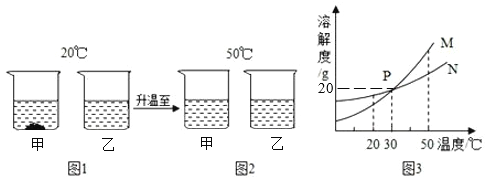
【题目】20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2(不考虑水分蒸发),甲、乙两种物质的溶解度曲线如图3,
请结合图示回答下列问题:
(1)图1中甲溶液是_____(填“饱和溶液”或“不饱和溶液”);
(2)图3中曲线N表示的是_____(填“甲”或“乙”)的溶解度曲线;
(3)将30℃时M的饱和溶液120g稀释成10%的溶液,需加水_____g;
(4)根据图中信息下列说法正确的是_____(填字母序号)
A 图2中乙溶液一定不饱和
B 图2中乙溶液降温至30℃有晶体析出
C 将图1两个烧杯中的溶液混合,充分搅拌后,烧杯中一定还有剩余的固体
D 将图1两个烧杯中的溶液温度升高到30℃,两烧杯内溶液中溶质的质量分数相等(不考虑水的蒸发)
【答案】饱和溶液 乙 80 AD
【解析】
(1)20℃时,甲一定是饱和溶液,因为烧杯中有属于固体;
(2)如图1和图2所示可知20℃,甲的溶解度较小,因为甲固体在图1中有剩余,故M是甲物质的溶解度曲线,N是乙物质的溶解度曲线;
(3)设需要加水的质量为m,根据稀释前后溶质质量不变列方程:![]() ,解得m=80g;
,解得m=80g;
(4)A、图1中乙溶液不含有未溶解的固体,不一定是不饱和,但随着温度的升高,该物质的溶解度增大,所以图2中乙一定是不饱和溶液,正确;
B、图2中乙溶液降温至30℃不一定形成乙的饱和溶液,不一定会有晶体析出,错误;
C、图1中甲烧杯剩余的固体可能会被烧杯2中的水溶解完,错误;
D、升高至30℃,甲烧杯的固体完全溶解,甲乙两烧杯中溶质和溶剂质量均相等,故溶质的质量分数也相等,正确。
故选:AD。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】小苏打(主要成分为 NaHCO3)中常含有少量氯化钠。化学小组的同学为了测定小苏打中NaHCO3 的质量分数,进行了以下实验:将样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
物质 | 样品 | 消耗稀盐酸质量 | 反应后溶液质量 |
质量(g) | 18 | 150.8 | 160 |
已知 NaHCO3+HCl=NaCl+H2O+CO2↑,试计算:
(1)样品中的 NaHCO3 质量分数_____。(结果保留到 0.1%);
(2)所得溶液中溶质的质量分数_____。(结果保留到 0.1%)。