题目内容
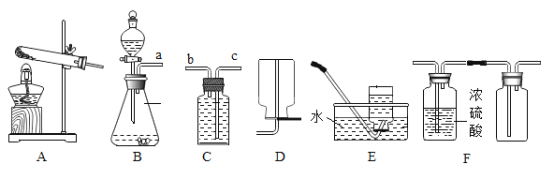
【题目】请根据下图回答相关问题:

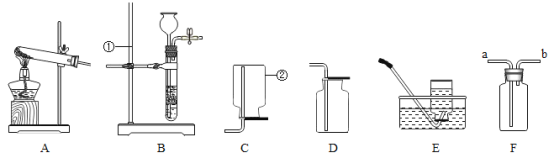
(1)仪器①的名称是_____________。
(2)若用高锰酸钾制备较为干燥的氧气,收集装置应选用仪器中的 _____________(填序号),用高锰酸钾制取氧气的方程式为_____________。
(3)若要在实验室制备二氧化碳,发生装置可选用仪器中的_____________(填序号);若采用 F装置制二氧化碳,则其突出优点是_____________。
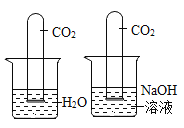
(4)某化学兴趣小组为了验证CO2与过氧化钠(Na2O2)的反应,已知过氧化钠(Na2O2)是一种淡黄色固体,与CO2、H2O发生反应,其中与水反应为Na2O2+2H2O=4NaOH+O2![]() 。
。
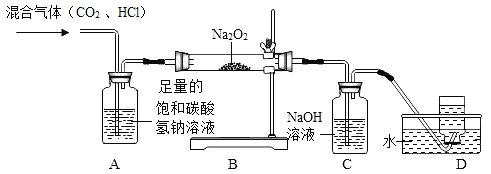
①装置 A的作用是______________。
②A与B之间还缺少一个装置,该装置中装的药品是______________,作用是 ______________。
③通入气体一段时间后,B中淡黄色固体逐渐变成白色固体,C中产生气泡,收集 D中产生的气体,伸入带火星的木条,木条复燃了。试写出 CO2与Na2O2反应的化学方程式:______________。
【答案】铁架台 C 2KMnO4![]() K2MnO4 + MnO2 + O2↑ B或F 能控制反应的发生与停止 除去氯化氢气体 浓硫酸 干燥二氧化碳 2Na2O2+2CO2=2Na2CO3+O2
K2MnO4 + MnO2 + O2↑ B或F 能控制反应的发生与停止 除去氯化氢气体 浓硫酸 干燥二氧化碳 2Na2O2+2CO2=2Na2CO3+O2
【解析】
(1)仪器①的名称是铁架台;
(2)氧气的密度比空气大,若用高锰酸钾制备较为干燥的氧气,收集装置应选用仪器中的C;高锰酸钾在加热的条件下生成猛酸钾、二氧化锰和氧气,反应的化学方程式为: 2KMnO4![]() K2MnO4 + MnO2 + O2↑;
K2MnO4 + MnO2 + O2↑;
(3)实验室常用大理石(或石灰石)和稀盐酸反应制取二氧化碳,属于固、液常温型,适合用装置B或F作发生装置;在装置F中,固体药品放在多孔隔板上,液体药品从长颈漏斗中加入。反应后关闭开关时,试管中的气体增多,压强增大,把液体压入长颈漏斗,固体和液体分离,反应停止,打开开关时,气体导出,试管中的气体减少,压强减小,液体和固体混合,反应进行。若采用F装置制二氧化碳,则其突出优点是能控制反应的发生与停止;
(4)①碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,所以装置A的作用是除去氯化氢气体;
②A与B之间还缺少一个装置,该装置中装的药品是浓硫酸,作用是干燥二氧化碳,防止验证CO2与过氧化钠(Na2O2)的反应产生干扰;
③根据实验现象可知,二氧化碳和过氧化钠反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。

【题目】某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)