题目内容
6.(1)酸雨给人类生活和社会发展带来了严重危害.汽车尾气是导致酸雨的重要原因,为减少有害气体的排放,人们在汽车排气管上安装“催化转化器”,使尾气中的一氧化碳和一氧化氮转化为空气中体积分数最多的气体N2(填化学式)和CO2.(2)化学反应中,元素的化合价升高,则该元素所在的反应物是还原剂,反之则为氧化剂.那么上述反应中的NO是氧化剂.
(3)上述反应产生的CO2大量排放会导致温室效应,植树造林、低碳环保刻不容缓.
实验室用澄清石灰水来检验二氧化碳气体,写出反应的化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O.
分析 (1)依据空气中含量最多的气体是氮气解答;
(2)依据题干中氧化剂与还原剂的化合价升降分析解答即可;
(3)依据温室效应的产生原因进行分析.二氧化碳能和澄清石灰水指导氢氧化钙反应生成碳酸钙沉淀和水;
解答 解:(1)由题干的信息可知该反应的反应物是一氧化碳和一氧化氮,生成物是氮气与二氧化碳,其化学方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;空气中含量最多的气体是氮气;
(2)因为化学反应中,元素的化合价升高,则该元素所在的反应物是还原剂,反之则为氧化剂,在该反应中反应前氮元素化合价为+2价,反应后氮的化合价变为0价,所以NO应该是该反应的氧化剂.
(3)大气中二氧化碳的含量升高容易导致温室,所以该反应中二氧化碳气体的大量排放容易导致温室效应的产生;氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
答案:
(1)N2;
(2)氧化;
(3)温室效应;Ca(OH)2+CO2═CaCO3↓+H2O;
点评 此题是一道与环保相关的题目,均是所学基础知识的相关衍生题,体现了化学基础知识的重要性.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
17.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁元素的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析.
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2 反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$→_{△}^{H_{2}SO_{4}}$CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是d(填字母编号).
【问题讨论】用如图所示装置进行实验:
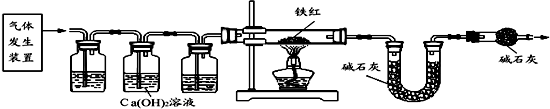
(2)实验前应先检查装置的气密性.
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式CO2+2NaOH=Na2CO3+H2O.
(5)B装置的作用是验证CO2已除尽.
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸. ②停止加热后驱赶装置中滞留的CO2,使其全部被E装置中碱石灰全部吸收.
(7)写出D装置中所发生反应的一个化学方程式Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
(8)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数.
①D中充分反应后得到Fe粉的质量为m g,则7.0<m<7.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%.
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷缺少尾气处理装置.
[资料1]碱石灰既能吸收水又能吸收二氧化碳;浓硫酸可以吸收水蒸气;
[资料2]实验室常用氢氧化钠溶液来除去CO2 反应生成碳酸钠和水;用澄清的石灰水
来检验CO2气体;
[资料3]草酸晶体(H2C2O4•3H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O4•3H2O$→_{△}^{H_{2}SO_{4}}$CO2↑+CO↑+4H2O
(1)下列可用作草酸分解制取气体的装置是d(填字母编号).

【问题讨论】用如图所示装置进行实验:

(2)实验前应先检查装置的气密性.
(3)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是c、a(填字母编号).
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(4)写出A装置中发生的化学反应方程式CO2+2NaOH=Na2CO3+H2O.
(5)B装置的作用是验证CO2已除尽.
(6)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸. ②停止加热后驱赶装置中滞留的CO2,使其全部被E装置中碱石灰全部吸收.
(7)写出D装置中所发生反应的一个化学方程式Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
【数据分析与计算】
[资料4]铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
①D中充分反应后得到Fe粉的质量为m g,则7.0<m<7.78.
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是76.0%.
【实验评价】
反思1:本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会偏小(填“偏小”、“不变”或“偏大”).
反思2:请指出【问题讨论】中实验装置的一个明显缺陷缺少尾气处理装置.
1.绿原酸(C16H18O9)被誉为“第七类营养素”,它可以从栽种较广的杜仲中提取.下列有关绿原酸的说法错误的是( )
| A. | 绿原酸含有33个原子 | |
| B. | 该绿原酸中C、H、O的原子个数比为16:18:9 | |
| C. | 在一定条件下,可燃烧生成CO2和H2O | |
| D. | 绿原酸(C16H18O9)相对分子质量为354 |
18.“神七”飞天,国人骄傲.下列有关“神七”的活动中,其侧重于化学学科研究领域的是( )
| A. | 开发“神七”飞控中心电脑程序 | |
| B. | “神七”搭载固体润滑材料进行太空性质实验 | |
| C. | “神七”搭载番茄种子进行太空育种 | |
| D. | 胡锦涛主席与“神七”航天员天地通话 |
 .
.

