题目内容
(2013?海门市二模)将过量的Na2CO3溶液滴入到CuSO4溶液中得到蓝绿色固体.某研究性学习小组对蓝绿色固体的成分进行了如下探究.
【提出假设】
猜想Ⅰ:固体为【CuCO3,理由是
猜想Ⅱ:固体为Cu(OH)2,理由是Na2CO3溶液呈
猜想Ⅲ:固体为CuCO3和Cu (OH)2混合物.
【查阅资料】如下:
1、Cu(OH)2和CuCO3晶体均不带结晶水.
2、Cu(OH)2、CuCO3受热易分解,Cu(OH)2
CuO+H2O,CuCO3
H2O+CO2 ↑.
3、无水硫酸铜白色固体,吸水后显蓝色.
【成分探究】
(1)固体的获取:
①将反应后的固、液混合物经
②判断固体已洗净,可以选用的试剂是
A.稀盐酸 B.Na2CO3 C.BaCl2溶液
③低温烘干蓝绿色固体的原因
(2)甲同学用图1所示方案,探究固体的成分,并得到下列现象: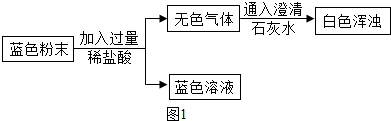
①图1中无色气体为
②通过测定蓝色溶液的pH,可以判断稀盐酸是否过量.pH测定的方法是
③上述实验方案所能得出的结论是一定含有
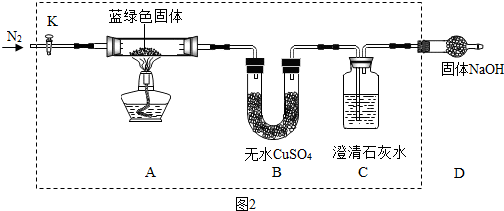
(3)乙同学实验方案如图2所示,
①若观察到B中现象为
②如果要确定固体成分中CuCO3和Cu (OH)2的质量比,则还需进行的主要实验操作为
【提出假设】
猜想Ⅰ:固体为【CuCO3,理由是
Na2CO3+CuSO4=CuCO3↓+Na2SO4
Na2CO3+CuSO4=CuCO3↓+Na2SO4
(用化学方程式表示).猜想Ⅱ:固体为Cu(OH)2,理由是Na2CO3溶液呈
碱
碱
(填“酸”或“碱”)性.猜想Ⅲ:固体为CuCO3和Cu (OH)2混合物.
【查阅资料】如下:
1、Cu(OH)2和CuCO3晶体均不带结晶水.
2、Cu(OH)2、CuCO3受热易分解,Cu(OH)2
| ||
| ||
3、无水硫酸铜白色固体,吸水后显蓝色.
【成分探究】
(1)固体的获取:
①将反应后的固、液混合物经
过滤
过滤
、洗涤、低温烘干得蓝绿色固体.②判断固体已洗净,可以选用的试剂是
A
A
.A.稀盐酸 B.Na2CO3 C.BaCl2溶液
③低温烘干蓝绿色固体的原因
防止蓝绿色固体受热分解
防止蓝绿色固体受热分解
.(2)甲同学用图1所示方案,探究固体的成分,并得到下列现象:

①图1中无色气体为
二氧化碳
二氧化碳
,所以猜想Ⅱ不成立.②通过测定蓝色溶液的pH,可以判断稀盐酸是否过量.pH测定的方法是
将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将pH试纸呈现的颜色与标准比色卡对照即可
将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将pH试纸呈现的颜色与标准比色卡对照即可
;③上述实验方案所能得出的结论是一定含有
CuCO3
CuCO3
,方案的不足之处是不能确定是否含有Cu(OH)2
不能确定是否含有Cu(OH)2
.(3)乙同学实验方案如图2所示,
①若观察到B中现象为
白色粉末变为蓝色
白色粉末变为蓝色
,C中现象为澄清石灰水变浑浊
澄清石灰水变浑浊
时,猜想Ⅲ是正确的;②如果要确定固体成分中CuCO3和Cu (OH)2的质量比,则还需进行的主要实验操作为
称量BC装置质量的增加量
称量BC装置质量的增加量
.
分析:【提出假设】猜想Ⅰ:根据碳酸钠与硫酸铜符合复分解反应发生的条件,反应能生成碳酸铜沉淀,对所得固体进行猜想,写出反应的化学方程式;
猜想Ⅱ:根据硫酸铜遇碱溶液可生成氢氧化铜的变化特点,对碳酸钠溶液的碱性进行猜想;
【成分探究】①根据所要分离混合物的组成特点,将不溶于液体的固体和液体分离;②因为加入的碳酸钠溶液过量,所以没洗净的固体上会含有碳酸钠,验证是否含有碳酸根离子就行;③根据蓝绿色固体受热易分解考虑;(2)①根据二氧化碳的验证方法考虑;②根据pH值的测定方法考虑;③根据加入盐酸能产生二氧化碳能说明固体中含有碳酸铜,但不能确定是否含有氢氧化铜;(3)①根据无水硫酸铜遇水变蓝色,二氧化碳的验证方法考虑;②根据称量BC装置质量的增加量计算出生成水和二氧化碳的质量,再计算出氢氧化铜和碳酸铜的质量考虑.
猜想Ⅱ:根据硫酸铜遇碱溶液可生成氢氧化铜的变化特点,对碳酸钠溶液的碱性进行猜想;
【成分探究】①根据所要分离混合物的组成特点,将不溶于液体的固体和液体分离;②因为加入的碳酸钠溶液过量,所以没洗净的固体上会含有碳酸钠,验证是否含有碳酸根离子就行;③根据蓝绿色固体受热易分解考虑;(2)①根据二氧化碳的验证方法考虑;②根据pH值的测定方法考虑;③根据加入盐酸能产生二氧化碳能说明固体中含有碳酸铜,但不能确定是否含有氢氧化铜;(3)①根据无水硫酸铜遇水变蓝色,二氧化碳的验证方法考虑;②根据称量BC装置质量的增加量计算出生成水和二氧化碳的质量,再计算出氢氧化铜和碳酸铜的质量考虑.
解答:解:【提出假设】猜想Ⅰ:碳酸钠和硫酸铜反应,符合复分解反应条件,相互交换成分,生成碳酸铜沉淀和硫酸钠,所以方程式是:Na2CO3+CuSO4=CuCO3↓+Na2SO4;
猜想Ⅱ:碳酸钠是强碱弱酸盐,在水中会进行水解生成氢氧根离子,显碱性;
【成分探究】(1)①过滤是将不溶性物质从溶液中分离的一种操作,该题需要将固、液分离,故答案为:过滤;
②固体上残留的碳酸钠会与盐酸反应生成二氧化碳气体,故答案为:取最后洗涤液少量,滴加适量的稀盐酸,无气泡产生,说明已经洗净了;
③由查阅资料可知蓝绿色固体受热易分解,所以低温烘烤是为了防止蓝绿色固体受热分解;
(2)①二氧化碳能使澄清石灰水变浑浊,所以该气体能使澄清石灰水变浑浊,说明该气体是二氧化碳;
②测pH值具体方法是:将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将pH试纸呈现的颜色与标准比色卡对照即可;
③固体加入盐酸能产生二氧化碳,说明固体中含有碳酸铜,该实验不足之处是不能确定是否含有氢氧化铜;
(3)①无水硫酸铜遇到水变蓝色,二氧化碳能使澄清石灰水变浑浊,所以如果B中现象是白色粉末变蓝色,C中澄清石灰水变浑浊,说明既生成了水又生成了二氧化碳,所以固体中既含有碳酸铜,又含有氢氧化铜;
②计算二者的质量比时,需要称量装置BC的质量的增加量,判断出生成水和二氧化碳的质量,再通过方程式计算出碳酸铜和氢氧化铜的质量.
故答案为:【提出假设】猜想Ⅰ:Na2CO3+CuSO4=CuCO3↓+Na2SO4;猜想Ⅱ:碱;【成分探究】①过滤;②A;③防止蓝绿色固体受热分解;(2)①二氧化碳;②将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将pH试纸呈现的颜色与标准比色卡对照即可;③CuCO3;不能确定是否含有Cu(OH)2;(3)①白色粉末变为蓝色;澄清石灰水变浑浊;②称量BC装置质量的增加量.
猜想Ⅱ:碳酸钠是强碱弱酸盐,在水中会进行水解生成氢氧根离子,显碱性;
【成分探究】(1)①过滤是将不溶性物质从溶液中分离的一种操作,该题需要将固、液分离,故答案为:过滤;
②固体上残留的碳酸钠会与盐酸反应生成二氧化碳气体,故答案为:取最后洗涤液少量,滴加适量的稀盐酸,无气泡产生,说明已经洗净了;
③由查阅资料可知蓝绿色固体受热易分解,所以低温烘烤是为了防止蓝绿色固体受热分解;
(2)①二氧化碳能使澄清石灰水变浑浊,所以该气体能使澄清石灰水变浑浊,说明该气体是二氧化碳;
②测pH值具体方法是:将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将pH试纸呈现的颜色与标准比色卡对照即可;
③固体加入盐酸能产生二氧化碳,说明固体中含有碳酸铜,该实验不足之处是不能确定是否含有氢氧化铜;
(3)①无水硫酸铜遇到水变蓝色,二氧化碳能使澄清石灰水变浑浊,所以如果B中现象是白色粉末变蓝色,C中澄清石灰水变浑浊,说明既生成了水又生成了二氧化碳,所以固体中既含有碳酸铜,又含有氢氧化铜;
②计算二者的质量比时,需要称量装置BC的质量的增加量,判断出生成水和二氧化碳的质量,再通过方程式计算出碳酸铜和氢氧化铜的质量.
故答案为:【提出假设】猜想Ⅰ:Na2CO3+CuSO4=CuCO3↓+Na2SO4;猜想Ⅱ:碱;【成分探究】①过滤;②A;③防止蓝绿色固体受热分解;(2)①二氧化碳;②将pH试纸放在玻璃片上,用玻璃棒蘸取待测液滴到pH试纸上,将pH试纸呈现的颜色与标准比色卡对照即可;③CuCO3;不能确定是否含有Cu(OH)2;(3)①白色粉末变为蓝色;澄清石灰水变浑浊;②称量BC装置质量的增加量.
点评:本题综合性很强,考查了多方面的知识,还给出了一些信息,从所给信息中提取出有用的信息才能正确回答问题,难度较大.

练习册系列答案
相关题目
 (2013?海门市二模)如图是实验室制取气体的部分装置,下列说法不正确的是( )
(2013?海门市二模)如图是实验室制取气体的部分装置,下列说法不正确的是( )
 (2013?海门市二模) 关注碳排放.
(2013?海门市二模) 关注碳排放.