题目内容
向12g石灰石(所含杂质不溶于水,也不溶于酸)中加入43.8g盐酸溶液,恰好完全反应,产生CO2气体4.4g.请计算:该石灰石中所含碳酸钙的质量分数.(结果精确到0.1%)
【答案】分析:根据题意可以知道所发生的反应为碳酸钙和盐酸的反应,而本题中的数据只有二氧化碳的质量是纯净物的质量,故可以带入求算,写出化学方程式并代入二氧化碳的质量计算出碳酸钙的质量,进而求算出碳酸钙的质量分数.
解答:解:设原固体中含碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
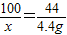
解得:x=10g
所以原固体中含碳酸钙的质量分数为: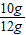 ×100%=83.3%
×100%=83.3%
答:原固体中含碳酸钙的质量分数为83.3%.
答:石灰石中所含碳酸钙的质量分数为83.3%.
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,同时要熟悉质量分数的计算.
解答:解:设原固体中含碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
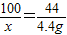
解得:x=10g
所以原固体中含碳酸钙的质量分数为:
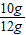 ×100%=83.3%
×100%=83.3%答:原固体中含碳酸钙的质量分数为83.3%.
答:石灰石中所含碳酸钙的质量分数为83.3%.
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,同时要熟悉质量分数的计算.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量溶质质量分数为7.3%的稀盐酸在烧杯(质量为50g)中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)有关实验数据如下表:
(1)配制实验过程中所需盐酸,需要36.5%的浓盐酸的质量为: g;
(2)发生反应的方程式为: ;
(3)求解12g该石灰石中碳酸钙质量(X)的比例式为: ;
(4)此石灰石样品中碳酸钙的质量分数是: ;
(5)向反应后所得溶液中加入116.4g水后,则最终溶液中溶质的质量分数是 ;
(6)该水泥厂用120g该石灰石可制得含杂质的生石灰的质量为 g.(结果保留一位小数)
| 反应前 | 反应前 | 反应后 | |
| 实 验 数 据 |
烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯中混合物的质量 |
| 150g | 12g | 157.6g |
(2)发生反应的方程式为:
(3)求解12g该石灰石中碳酸钙质量(X)的比例式为:
(4)此石灰石样品中碳酸钙的质量分数是:
(5)向反应后所得溶液中加入116.4g水后,则最终溶液中溶质的质量分数是
(6)该水泥厂用120g该石灰石可制得含杂质的生石灰的质量为