题目内容
在天平的两托盘的烧杯中分别放入相同质量且足量的稀盐酸,调节天平平衡,再往两烧杯中分别加入等质量的 Na2CO3和 CaCO3 待烧杯中的Na2CO3 和 CaCO3全部反应完毕后,天平的指针
- A.仍然留在原来的位置
- B.不能停止
- C.偏向Na2CO3的一边
- D.偏向CaCO3的一边
C
分析:反应物放在一起不反应的状态时,天平是平衡的,指针的偏转主要是看生成二氧化碳的多少,因此解题时判断二氧化碳多少则成为解题的关键所在.由于天平的两托盘的烧杯中分别放入相同质量且足量的稀盐酸,所以可计算相同质量的CaCO3和Na2CO3完全反应放出二氧化碳质量的大小,天平的指针会偏向质量大(下沉)的一方.
解答:假设两物质质量均为mg,设mgCaCO3反应放出二氧化碳质量为x,mgNa2CO3反应放出二氧化碳质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
mg x
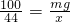
解之得 x= g
g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
mg y
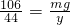
解之得 y=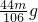 ,
,
比较可知等质量的两种碳酸盐完全反应,碳酸钙产生的气体二氧化碳多,质量的增加值偏小,则加入碳酸钙的天平端上升,偏向Na2CO3的一边;
故选C
点评:本题是比较抽象的根据化学方程式的计算,解本题的关键是分析左右两盘实际质量的变化.
分析:反应物放在一起不反应的状态时,天平是平衡的,指针的偏转主要是看生成二氧化碳的多少,因此解题时判断二氧化碳多少则成为解题的关键所在.由于天平的两托盘的烧杯中分别放入相同质量且足量的稀盐酸,所以可计算相同质量的CaCO3和Na2CO3完全反应放出二氧化碳质量的大小,天平的指针会偏向质量大(下沉)的一方.
解答:假设两物质质量均为mg,设mgCaCO3反应放出二氧化碳质量为x,mgNa2CO3反应放出二氧化碳质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
mg x
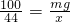
解之得 x=
 g
gNa2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
mg y
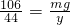
解之得 y=
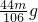 ,
,比较可知等质量的两种碳酸盐完全反应,碳酸钙产生的气体二氧化碳多,质量的增加值偏小,则加入碳酸钙的天平端上升,偏向Na2CO3的一边;
故选C
点评:本题是比较抽象的根据化学方程式的计算,解本题的关键是分析左右两盘实际质量的变化.

练习册系列答案
相关题目