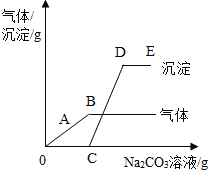
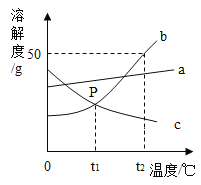
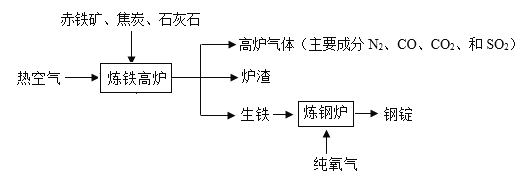
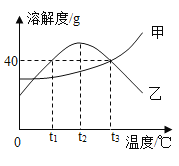
题目内容
【题目】利用稀盐酸与金属单质反应,探究镁、铁、铜的金属活动性。下列说法正确的是
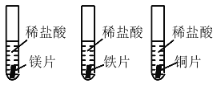
A.铜片表面可以观察到气泡
B.铁片的试管比镁片的试管更热
C.金属活动性由强到弱顺序为:镁>铁>铜
D.三支试管中盐酸溶液的质量分数可以不同
【答案】C
【解析】
稀盐酸和镁反应生成氯化镁和氢气,铁和稀盐酸反应生成氯化亚铁和氢气,铜和稀盐酸不反应。
A、铜的金属活动性比氢弱,与稀盐酸不反应,铜片表面无明显变化,故A不正确;
B、金属与酸的反应属于放热反应,由于金属的活动性Mg>Fe,镁反应更剧烈,镁片的试管表面更热,故B不正确;
C、根据金属活动性顺序,活动性顺序为镁>铁>铜,故C正确;
D、探究镁、铁、铜的金属活动性时,要注意变量的控制,注意要除探究要素不同之外,其它条件都应该是相同的,则盐酸的浓度必须相同,故D不正确。故选C。

练习册系列答案
相关题目
【题目】如图甲、乙、丙、丁是初中化学中常见的四种物质。“→”表示物质间的转化关系 (部分反应物、生成物及反应条件已省略)。不能实现如图转化的是( )
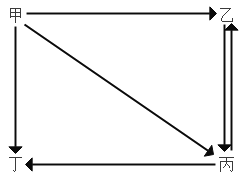
选项 | A | B | C | D | |
物质 | 甲 | CuSO4 | Na2CO3 | C | O2 |
乙 | Cu(OH)2 | CaCO3 | CO2 | CO | |
丙 | CuCl2 | CO2 | CO | CO2 | |
丁 | Cu(NO3)2 | NaOH | Cu | H2O | |
A.AB.BC.CD.D