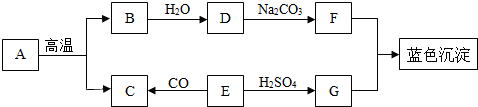
题目内容
已知某粗盐样品中含有Na2SO4,MgCl2,CaCl2等杂质.实验室提纯流程如图: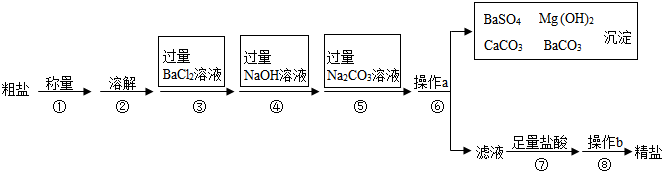
(1)第⑥步操作a的名称是 ,此步操作中,玻璃棒的末端要轻轻地斜靠在 的一边.
(2)第⑤步操作发生反应的化学方程式是
(3)第④步操作的目的是
(4)操作a后得到的沉淀的化学式是
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是 .
(6)在第⑧步操作时,要用玻璃棒不断搅拌,目的是 .
(7)步骤③中的试剂能否换成Ba(NO3)2 ;原因为 .
(8)步骤③与步骤⑤的顺序(填“可以”或“不可以”) 颠倒?若不可以,其原因是 (选择可以的,则此空不必填写)

(1)第⑥步操作a的名称是
(2)第⑤步操作发生反应的化学方程式是
(3)第④步操作的目的是
(4)操作a后得到的沉淀的化学式是
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是
(6)在第⑧步操作时,要用玻璃棒不断搅拌,目的是
(7)步骤③中的试剂能否换成Ba(NO3)2
(8)步骤③与步骤⑤的顺序(填“可以”或“不可以”)
考点:氯化钠与粗盐提纯,过滤的原理、方法及其应用,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的盐 化学肥料
分析:(1)根据过滤“一贴、二低、三靠”的操作要领,进行分析;
(2)考虑碳酸钠溶液与氯化钡、氯化钙溶液的反应;
(3)根据加入过量氢氧化钠溶液的目的是除去氯化镁进行解答;
(4)由图框可知,操作a后得到的沉淀的化学式;
(5)根据在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3进行解答;
(6)根据蒸发结晶过程中玻璃棒的作用进行解答.
(7)考虑除杂质,不能引进新的杂质;
(8)根据加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2进行解答;
(2)考虑碳酸钠溶液与氯化钡、氯化钙溶液的反应;
(3)根据加入过量氢氧化钠溶液的目的是除去氯化镁进行解答;
(4)由图框可知,操作a后得到的沉淀的化学式;
(5)根据在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3进行解答;
(6)根据蒸发结晶过程中玻璃棒的作用进行解答.
(7)考虑除杂质,不能引进新的杂质;
(8)根据加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2进行解答;
解答:解:
(1)过滤用于分离难溶性固体和可溶性固体的方法,第⑥步操作a的名称是过滤,此步操作中,玻璃棒的末端要轻轻地斜靠在三层滤纸的一边;
(2)第⑤步操作发生反应为碳酸钠与氯化钡、氯化钙溶液的反应,故化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)加入过量氢氧化钠溶液的目的是完全除去氯化镁,发生反应的化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(4)由题目中的图框可知:操作a后得到的沉淀的化学式是BaSO4、Mg(OH)2、CaCO3、BaCO3;
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3;
(6)蒸发结晶过程中玻璃棒的作用:防止蒸发时因局部温度过高,造成液滴飞溅.
(7)如果步骤③中的试剂换成Ba(NO3)2,会引进新的杂质硝酸根且无法除掉;
(8)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,步骤③和步骤⑤颠倒后,则粗盐中会含有过量的BaCl2
故答案为:
(1)过滤,滤纸三层.
(2)BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)完全除去氯化镁
(4)BaSO4、Mg(OH)2、CaCO3、BaCO3
(5)除去加入的过量试剂NaOH和Na2CO3.
(6)防止蒸发时因局部温度过高,造成液滴飞溅.
(7)否;会引进新的杂质硝酸根而无法除掉.
(8)不可以、无法除去过量的BaCl2
(1)过滤用于分离难溶性固体和可溶性固体的方法,第⑥步操作a的名称是过滤,此步操作中,玻璃棒的末端要轻轻地斜靠在三层滤纸的一边;
(2)第⑤步操作发生反应为碳酸钠与氯化钡、氯化钙溶液的反应,故化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl;
(3)加入过量氢氧化钠溶液的目的是完全除去氯化镁,发生反应的化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(4)由题目中的图框可知:操作a后得到的沉淀的化学式是BaSO4、Mg(OH)2、CaCO3、BaCO3;
(5)在第⑦步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量试剂NaOH和Na2CO3;
(6)蒸发结晶过程中玻璃棒的作用:防止蒸发时因局部温度过高,造成液滴飞溅.
(7)如果步骤③中的试剂换成Ba(NO3)2,会引进新的杂质硝酸根且无法除掉;
(8)加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,步骤③和步骤⑤颠倒后,则粗盐中会含有过量的BaCl2
故答案为:
(1)过滤,滤纸三层.
(2)BaCl2+Na2CO3=BaCO3↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)完全除去氯化镁
(4)BaSO4、Mg(OH)2、CaCO3、BaCO3
(5)除去加入的过量试剂NaOH和Na2CO3.
(6)防止蒸发时因局部温度过高,造成液滴飞溅.
(7)否;会引进新的杂质硝酸根而无法除掉.
(8)不可以、无法除去过量的BaCl2
点评:本题从多个角度对氯化钠的提纯实验进行了全面考察,灵活性强.

练习册系列答案
相关题目
下列图象与所述实验相符的是( )
A、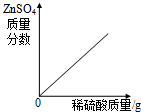 向一定量锌粒中加入过量稀硫酸 |
B、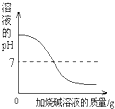 向稀盐酸中滴加过量的烧碱溶液 |
C、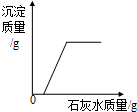 向一定量氢氧化钠和碳酸钠的混合溶液中加入过量的石灰水 |
D、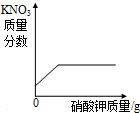 20℃时,向一定量不饱和的硝酸钾溶液中加入过量的硝酸钾晶体 |
下列实验现象的描述正确的是( )
| A、硫在空气中燃烧,发出蓝紫色火焰 |
| B、木炭在空气中燃烧发出白光,生成有刺激性气味的气体 |
| C、镁在氧气中燃烧,生成白色固体 |
| D、打开浓盐酸的瓶塞能看到白雾 |
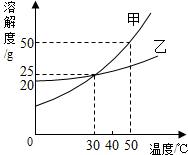 如图所示为甲、乙两物质(均不含结晶水)的溶解度曲线.请根据曲线回答以下问题:
如图所示为甲、乙两物质(均不含结晶水)的溶解度曲线.请根据曲线回答以下问题: