题目内容
(2012?闸北区一模)为了测定某石灰石中碳酸钙的质量分数(假设杂质不参加反应,且不溶于水),某兴趣小组设计如下实验方案:①称取10g石灰石样品,②高温煅烧至质量不再改变,③把剩余固体放在空气中冷却至室温,④称得剩余固体的质量为6.04g.
①在方案中产生二氧化碳的质量为
②根据方案计算石灰石中碳酸钙的质量分数(根据化学方程式列式计算).
③指出该实验方案中一处明显的不足并说明原因
①在方案中产生二氧化碳的质量为
3.96g
3.96g
g,其物质的量为0.09
0.09
mol.②根据方案计算石灰石中碳酸钙的质量分数(根据化学方程式列式计算).
③指出该实验方案中一处明显的不足并说明原因
在空气中冷却,氧化钙会吸收水分生成氢氧化钙
在空气中冷却,氧化钙会吸收水分生成氢氧化钙
..分析:①根据质量守恒定律可知固体质量的减少量就是生成二氧化碳的质量,用二氧化碳的质量除以它的相对分子质量就是物质的量;②根据二氧化碳的质量计算出碳酸钙的质量,再除以石灰石的质量即可;③因为氧化钙具有吸水性所以不能在空气中冷却.
解答:解:①在方案中产生二氧化碳的质量为:10g-6.04g=3.96g,其物质的量为:
=0.09mol;
②设要生成3.96g 二氧化碳需要碳酸钙质量为X则:
CaCO3
CaO+CO2↑
100 44
X 3.96g
根据:
=
解得X=9g,石灰石中碳酸钙的质量分数:
×100%=90%;
③因为氧化钙具有吸水性所以不能在空气中冷却,否则氧化钙与水反应生成氢氧化钙,导致质量减少的少了,造成误差.
故答案为:①3.96g;0.09;②90%;③在空气中冷却,氧化钙会吸收水分生成氢氧化钙.
| 3.96g |
| 44g/mol |
②设要生成3.96g 二氧化碳需要碳酸钙质量为X则:
CaCO3
| ||
100 44
X 3.96g
根据:
| 100 |
| 44 |
| X |
| 3.96g |
| 9g |
| 10g |
③因为氧化钙具有吸水性所以不能在空气中冷却,否则氧化钙与水反应生成氢氧化钙,导致质量减少的少了,造成误差.
故答案为:①3.96g;0.09;②90%;③在空气中冷却,氧化钙会吸收水分生成氢氧化钙.
点评:解答本题的关键是固体质量的减少量是生成二氧化碳的质量,根据二氧化碳计算出碳酸钙的质量,要熟记氧化钙具有吸水性.

练习册系列答案
相关题目
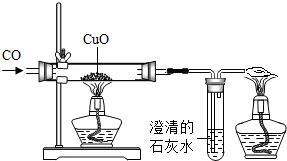 (2012?闸北区一模)如图是一氧化碳还原氧化铜的实验装置图.实验步骤是:①组装检验装置的气密性;②装入药品,通入一段时间一氧化碳;③加热左边酒精灯,使其充分反应;④停止加热,继续通入一氧化碳至恢复到室温.
(2012?闸北区一模)如图是一氧化碳还原氧化铜的实验装置图.实验步骤是:①组装检验装置的气密性;②装入药品,通入一段时间一氧化碳;③加热左边酒精灯,使其充分反应;④停止加热,继续通入一氧化碳至恢复到室温.