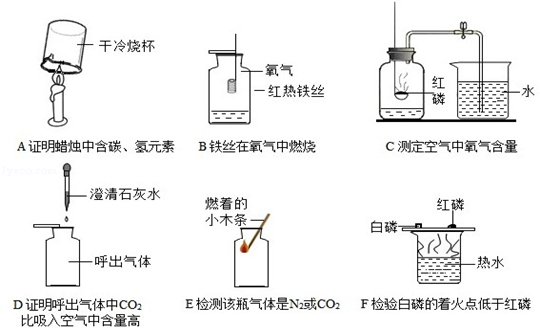
题目内容
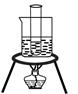
已知:①一定温度下,硫酸铜受热分解生成CuO、SO3、SO2和O2;②SO3、SO2都能被碱石灰和氢氧化钠溶液吸收。利用下图装置加热10.0g硫酸铜粉末直至完全分解,各装置的质量变化关系如下表所示:
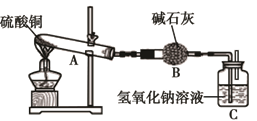

 该实验条件下,硫酸铜分解的化学方程式是
该实验条件下,硫酸铜分解的化学方程式是
A.4CuSO4 4CuO + 2SO3↑ + 2SO2↑ + O2↑
 B.3CuSO4 3CuO + SO3↑ + 2SO2↑ + O2↑
B.3CuSO4 3CuO + SO3↑ + 2SO2↑ + O2↑

 C.5CuSO4 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
C.5CuSO4 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
D.6CuSO4 6CuO + 4SO3↑ + 2SO2↑ + O2↑

| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.5g | 140.0g |

 该实验条件下,硫酸铜分解的化学方程式是
该实验条件下,硫酸铜分解的化学方程式是A.4CuSO4 4CuO + 2SO3↑ + 2SO2↑ + O2↑
 B.3CuSO4 3CuO + SO3↑ + 2SO2↑ + O2↑
B.3CuSO4 3CuO + SO3↑ + 2SO2↑ + O2↑ 
 C.5CuSO4 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑
C.5CuSO4 5CuO + SO3↑ + 4SO2↑ + 2O2 ↑ D.6CuSO4 6CuO + 4SO3↑ + 2SO2↑ + O2↑
A
试题分析:根据质量守恒定律可知,装置A在反应前后减少的质量,即为反应生成的气体的质量=42.0g-37.0g=5g,则反应生成的氧化铜的质量=10g-5g=5g;由于干燥管B完全吸收了二氧化硫和三氧化硫,则这两种气体的质量=79.5g-75g=4.5g,由于反应一共生成了三种气体,则反应生成的氧气的质量=5g-4.5g=0.5g;由此可知,参加反应的硫酸铜和生成的氧化铜及生成的氧气的质量比为10g:5g:0.5g=20:10:1,可设化学方程式中这三种物质的化学计量数分别为a、b、c,则它们的质量之比为160a: 80b:32c=20:10:1,则a:b:c=4:4:1。故选A
点评:本题主要考查了质量守恒定律的应用,解题的关键是,根据装置中的质量变化分析判断出各物质的质量,然后再求出方程式中物质的化学计量数的比。

练习册系列答案
 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目