题目内容
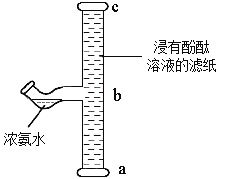
【题目】甲、乙两种固体物质的溶解度曲线如图所示。现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯中,再向烧杯中加入一定量氢氧化钠固体。
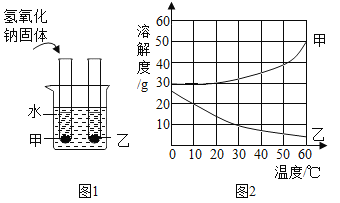
(1)50℃时,甲物质的溶解度是________。
(2)30℃时,甲、乙两种物质的溶解度大小顺序是________。
(3)烧杯中加入氢氧化钠后,甲、乙两试管中固体量的变化是____________________。除了加氢氧化钠外,还可以加________物质也会发生这样的变化。
【答案】40g 甲>乙 甲减少,乙增多 浓硫酸(或CaO)
【解析】
(1)由甲、乙两种固体物质的溶解度曲线图可知:50℃时,甲物质的溶解度是40g。
(2)由甲、乙两种固体物质的溶解度曲线图可知:30℃时,甲、乙两种物质的溶解度大小顺序是甲>乙。
(3)由图可知:甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小;因为氢氧化钠溶于水放热,则溶液温度升高,甲溶解度增大,试管中固体减少,乙溶解度减小,试管中固体增多。除了加氢氧化钠外,加入硫酸也会放热,发生这样的变化,加入氧化钙,氧化钙与水反应生成氢氧化钙,放出大量的热,也会发生这样的变化。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】现有一包黑色固体粉末,可能含有炭粉、氧化铜、四氧化三铁中的两种或者三种,某化学兴趣小组通过实验探究其成分。
(提出问题):该黑色固体粉末成分是什么?
(作出猜想):
猜想一:混合固体是炭粉、氧化铜 猜想二:混合固体是炭粉、四氧化三铁
猜想三:混合固体是氧化铜、 四氧化三铁 猜想四:混合固体是______
(查阅资料):
①Fe3O4能与盐酸反应
②含有Fe3+的盐溶液遇到KSCN(硫氰化钾)溶液时变成红色
③Fe(OH)2是一种白色沉淀,化学性质不稳定,最终转化为红褐色沉淀
(定性探究):
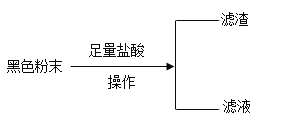
(1)在“操作”中需要用的玻璃仪器有:烧杯、玻璃棒、_____,玻璃棒的作用为_____,所得滤渣为______(填化学式);
(2)取滤液进行如下探究:(表格内填化学式)
实验操作 | 实验现象 | 实验结论 |
步骤一:取一定量的滤液于试管中,加入足量的铁粉 | 无红色固体析出 | 该固体中一定没有____ |
步骤二:又取一定量的滤液于试管中,加入少量的KSCN(硫氰化钾)溶液 | 溶液变成红色 | 滤液中一定含有的物质是______ |
步骤三:再取一定量的滤液于试管中,加入足量的NaOH溶液 | 有红褐色沉淀生成,同时还有少量的白色沉淀生成,白色沉淀迅速变成灰绿色,最终全部变成红褐色 | 滤液中还一定含有的物质是___ |
(讨论交流):
(1)步骤三中滤液里加入氢氧化钠溶液产生红褐色沉淀化学方程式是_____;
(2)通过以上实验,猜想 ________成立;
(3)Fe3O4与盐酸反应时元素的化合价没有改变,请大家推断Fe3O4中铁元素的化合价为____、____;
(4)现取该黑色粉末,经过以下操作,将该粉末中的铁元素全部转化为铁单质:步骤:_____。
(定量分析):
该化学兴趣小组取5g该黑色粉末,加入足量的盐酸后得到0.6g滤渣,则该黑色粉中的其他元素的质量分别是____?(写出计算过程,结果保留一位小数)