题目内容
人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属.
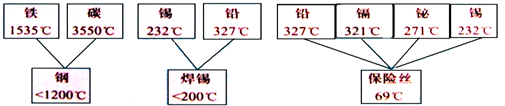
(1)上图表示金属活动性顺序中铝、铁和铜被人类大规模开发利用的大致年限,根据图中数据和相关化学知识,你认为金属大规模开发利用的先后顺序与下列因素无关.
A.金属冶炼的难易程度 B.地壳中金属元素的含量 C.金属的活动性
(2)请用一个化学方程式说明铁的金属活动性比铜强.______
(3)生活中由于钢铁与______直接接触容易生锈造成损失,防止钢铁制品生锈的常用方法有(只填一种)______.
(4)工业上电解氧化铝制取金属铝的化学方程式是:2Al2O3 td 4Al+3O2↑,电解51t的氧化铝最多可生产多少吨铝?
(5)实际生产中氧化铝可从铝土矿提炼获得.要生产相同质量的铝,所需铝土矿的质量应______ (填“大于”“小于”或“等于”)氧化铝质量.
【答案】分析:(1)根据所利用的三种金属的活动性考虑;(2)根据活泼的金属能把不活泼金属从盐溶液中置换出来考虑;(3)根据生锈的条件:与氧气和水结合;防止生锈的方法:隔绝氧气、隔绝水考虑;(4)根据方程式计算即可;(5)根据铝土矿中含有其它杂质考虑.
解答:解:(1)由三种金属可知越早使用的金属越不活泼,越活泼的金属用的越晚,所以与金属的活动性有关;
(2)铁与硫酸铜反应生成铜和硫酸亚铁,所以方程式是:Fe+CuSO4═FeSO4+Cu;
(3)钢铁生锈的条件是与氧气和水共同接触,防止生锈的方法:镀一层其它金属,保持铁制品表面洁净干燥,涂油或刷漆;
(4)解:设电解51 t的氧化铝最多可生产铝的质量为X则:
2Al2O3 4Al+3O2↑,
4Al+3O2↑,
204 108
51t X
根据: 解得X=27t.
解得X=27t.
(5)由于铝土矿中含有其它杂质所以实际生产中氧化铝可从铝土矿提炼获得.要生产相同质量的铝,所需铝土矿的质量应大于氧化铝的质量.
故答案为:(1)B;(2)Fe+CuSO4═FeSO4+Cu(如写出Fe+2HCl═FeCl2+H2↑,但有说明铜不与酸反应也给分);(3)氧气和水 在钢铁制品表面刷油漆(或涂油;电镀等);(4)27 t;(5)大于.
点评:解答本题关键是熟悉金属活动性顺序,知道方程式的书写注意事项,钢铁生锈的条件和防止生锈的方法.知道方程式的简单计算.
解答:解:(1)由三种金属可知越早使用的金属越不活泼,越活泼的金属用的越晚,所以与金属的活动性有关;
(2)铁与硫酸铜反应生成铜和硫酸亚铁,所以方程式是:Fe+CuSO4═FeSO4+Cu;
(3)钢铁生锈的条件是与氧气和水共同接触,防止生锈的方法:镀一层其它金属,保持铁制品表面洁净干燥,涂油或刷漆;
(4)解:设电解51 t的氧化铝最多可生产铝的质量为X则:
2Al2O3
 4Al+3O2↑,
4Al+3O2↑,204 108
51t X
根据:
 解得X=27t.
解得X=27t.(5)由于铝土矿中含有其它杂质所以实际生产中氧化铝可从铝土矿提炼获得.要生产相同质量的铝,所需铝土矿的质量应大于氧化铝的质量.
故答案为:(1)B;(2)Fe+CuSO4═FeSO4+Cu(如写出Fe+2HCl═FeCl2+H2↑,但有说明铜不与酸反应也给分);(3)氧气和水 在钢铁制品表面刷油漆(或涂油;电镀等);(4)27 t;(5)大于.
点评:解答本题关键是熟悉金属活动性顺序,知道方程式的书写注意事项,钢铁生锈的条件和防止生锈的方法.知道方程式的简单计算.

练习册系列答案
相关题目

 人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.
人们的日常生活离不开金属,高科技新材料的开发和利用也需要金属.