题目内容
归纳总结是学习化学的重要方法来学习化学知识.请回答下列问题:(1)“一碳化学”是以一个分子中只含一个碳原子的化合物为原料来合成一系列化工原料和燃料的化学.
①甲烷的化学式是
②炼铁时用一氧化碳还原氧化铁的化学方程式
③在催化剂存在的条件下,用CO和H2合成甲醇(CH4O),写出反应的化学方程式

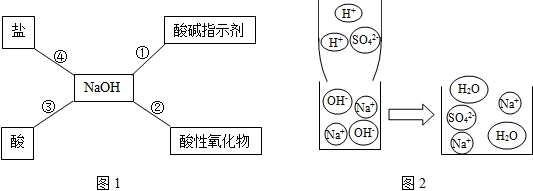
(2)酸碱盐之间能相互反应.碱与盐之间若有气体生成,反应就能发生,请写出该气体的化学式
酸与盐之间能发生反应,分析右图,写出反应的化学方程式
(3)金属活动性顺序有重要的应用.
①将一段锌片插入到CuSO4溶液中,观察到明显的现象,反应的化学方程式为
②金属分别与水、水蒸气的反应情况如下表:
| 物质 | 镁与冷水 | 铁与冷水 | 铁与水蒸气 | 铜与冷水 | 铜与水蒸气 |
| 反应情况 | 缓慢反应 | 不反应 | 能反应 | 不反应 | 不反应 |
(填写代号).
A.不反应 B.缓慢反应
C.比镁与冷水反应快 D.比铁与水蒸气反应快
③已知在加热条件下铁与水蒸气反应生成四氧化三铁和氢气,该反应的化学方程式为
分析:(1)①甲烷是最简单的有机物,②根据质量守定律写出一氧化碳还原氧化铁的方程式,③根据质量守定律写出在催化剂存在的条件下,用CO和H2合成甲醇的方程式;
(2)铵盐与碱反应时有氨气放出放出;观察图示找出反应物、生成物,写出方程式;
(3)①根据金属活动性顺序写出反应的方程式;②根据金属活动性顺序,结合表中的反应情况分析镁与水蒸气的反应情况;③根据质量守定律写出在加热条件下铁与水蒸气反应生成四氧化三铁和氢气的方程式.
(2)铵盐与碱反应时有氨气放出放出;观察图示找出反应物、生成物,写出方程式;
(3)①根据金属活动性顺序写出反应的方程式;②根据金属活动性顺序,结合表中的反应情况分析镁与水蒸气的反应情况;③根据质量守定律写出在加热条件下铁与水蒸气反应生成四氧化三铁和氢气的方程式.
解答:解:(1)①甲烷的化学式是CH4;②炼铁时用一氧化碳还原氧化铁的化学方程式是:Fe2O3+3CO
2Fe+3CO2;③在催化剂存在的条件下,用CO和H2合成甲醇(CH4O),反应的化学方程式是:CO+2H2
CH4O
(2)铵盐与碱反应时有氨气放出,氨气的化学式是:NH3;由图示可知,硫酸与硝酸钡反应生成了硫酸钡沉淀和硝酸,方程式是:Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;
(3)①将一段锌片插入到CuSO4溶液中,观察到锌的表面有红色物质生成,反应的化学方程式为:Zn+CuSO4═ZnSO4+Cu;②根据金属活动性顺序可知,镁比铁活泼,水蒸汽的温度又比冷水的温度高,所以,镁与水蒸气的反应情况是:比镁与冷水反应快,比铁与水蒸气反应快.③在加热条件下铁与水蒸气反应生成四氧化三铁和氢气,该反应的化学方程式为:3Fe+4H2O
Fe3O4+4H2.
故答为:(1)①CH4 ;②Fe2O3+3CO
2Fe+3CO2;③CO+2H2
CH4O;(2)NH3,Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;(3)①Zn+CuSO4═ZnSO4+Cu;②CD;③3Fe+4H2O
Fe3O4+4H2↑
| ||
| ||
(2)铵盐与碱反应时有氨气放出,氨气的化学式是:NH3;由图示可知,硫酸与硝酸钡反应生成了硫酸钡沉淀和硝酸,方程式是:Ba(NO3)2+H2SO4=BaSO4↓+2HNO3;
(3)①将一段锌片插入到CuSO4溶液中,观察到锌的表面有红色物质生成,反应的化学方程式为:Zn+CuSO4═ZnSO4+Cu;②根据金属活动性顺序可知,镁比铁活泼,水蒸汽的温度又比冷水的温度高,所以,镁与水蒸气的反应情况是:比镁与冷水反应快,比铁与水蒸气反应快.③在加热条件下铁与水蒸气反应生成四氧化三铁和氢气,该反应的化学方程式为:3Fe+4H2O
| ||
故答为:(1)①CH4 ;②Fe2O3+3CO
| ||
| ||
| ||
点评:本题涉及的知识到较多,重点考查了化学用语的书写,化学用语是学习化学的工具,一定要熟练、规范、准确地书写常见的化学用语.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
归纳总结是学习化学的一种重要方法,下面是小亮同学总结出的结论,请你举出一个实例否定他的观点(要求用化学式或化学方程式表示).
| 序号 | 错误结论 | 否定实例 | ||||
| 例: | 燃烧一定有氧气参加 | 2Mg+CO2
| ||||
| ① | 常温下金属都是固体 | |||||
| ② | 物质的溶解度都随温度的升高而增大 | |||||
| ③ | 能生成CO2的反应都可用于实验室制取CO2 |


 归纳总结是学习化学的重要方法,如图是某同学对有关知识的总结,请依据下列几种化合物能通过一步反应转化为含镁化合物M的转化关系填写空格:如图中物质M属于
归纳总结是学习化学的重要方法,如图是某同学对有关知识的总结,请依据下列几种化合物能通过一步反应转化为含镁化合物M的转化关系填写空格:如图中物质M属于