题目内容
(
大连,2005)为了测定某磁铁矿中四氧化三铁的质量分数,甲、乙两组同学根据磁铁矿与一氧化碳反应的原理,分别利用两种方法测定了磁铁矿样品中四氧化三铁的质量分数.已知磁铁矿与一氧化碳反应的化学方程式如下(磁铁矿中的杂质不参加反应): .
.
(1)
甲组同学取该磁铁矿样品10g,与足量的一氧化碳充分反应,并将产生的气体通入足量的氢氧化钠溶液中,溶液的质量增加了5.5g.请你根据甲组同学的实验数据,计算该磁铁矿样品中四氧化三铁的质量分数.(2)
乙组同学取该磁铁矿样品16g,与足量的一氧化碳充分反应,测得反应后固体物质的质量为12.8g.请你根据乙组同学的实验数据,计算该磁铁矿样品中四氧化三铁的质量分数.
答案:72.5%;72.5%
解析:
解析:
|
(1) 设10g该磁铁矿样品中含有四氧化三铁的质量为x
232∶x=176∶5.5g x=7.25g 则该样品中四氧化三铁的质量分数为 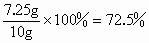
(2) 依题意可知:16g磁铁矿样品中含有氧元素的质量为16g-12.8g=3.2g则样品中四氧化三铁的质量为 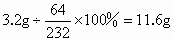
该样品中四氧化三铁的质量分数为 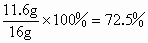 |

练习册系列答案
相关题目
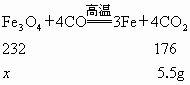
 (2005?大连)水是重要的自然资源,水资源不足,将严重影响人类的生存.请阅读下列有关资料:
(2005?大连)水是重要的自然资源,水资源不足,将严重影响人类的生存.请阅读下列有关资料: