题目内容
【题目】某工厂生产产品Na2CO3中含有少量NaHCO3样品,为了测定产品中Na2CO3质量分数,取20.0g样品进行如图实验,反应的化学方程式为:2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O 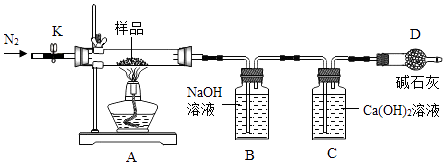
实验步骤如下:①打开K,缓慢通入干燥N2一段时间;
②关闭K,加热至一定温度使之反应.
③实验后,观察到C中的溶液不变浑浊,测得各装置质量如下:
实验前 | 实验后 | |
玻璃管及样品质量/g | 45.5 | 42.4 |
B装置质量/g | 100.5 | 103.6 |
问:
(1)B中发生反应的化学方程式为:
(2)D装置的作用是
(3)实验过程中,观察到 , 说明A中已反应完全;停止加热后,在冷却过程中要注意的问题 .
(4)根据实验所给数据,可测得Na2CO3质量分数为 .
【答案】
(1)2NaOH+CO2═Na2CO3+H2O
(2)防止空气中的二氧化碳和水蒸气进入C装置
(3)C中的溶液不变浑浊;先撤B、C装置,后熄灭酒精灯
(4)81.5%
【解析】解:(1)氢氧化钠溶液能吸收空气中的二氧化碳生成碳酸钠和水,所以B装置中发生反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;(2)碱石灰会与二氧化碳、水反应,所以D装置能防止空气中的二氧化碳和水蒸气进入C装置;(3)二氧化碳和氢氧化钙反应会生成碳酸钙沉淀和水,所以实验过程中,观察到C中的溶液不变浑浊,停止加热后,在冷却过程中要注意的问题是:先撤B、C装置,后熄灭酒精灯;(4)固体减少的质量为:45.5g﹣42.4g=3.1g,设样品中碳酸氢钠的质量为x
2NaHCO3 |
| Na2CO3+CO2↑+H2O | 固体减少 |
168 | 62 | ||
x | 3.1g |
![]() =
= ![]()
x=8.4g
所以Na2CO3质量分数为 ![]() ×100%=81.5%.
×100%=81.5%.
所以答案是:(1)2NaOH+CO2═Na2CO3+H2O;(2)防止空气中的二氧化碳和水蒸气进入C装置;(3)C中的溶液不变浑浊,先撤B、C装置,后熄灭酒精灯;(4)81.5%.
【考点精析】本题主要考查了书写化学方程式、文字表达式、电离方程式的相关知识点,需要掌握注意:a、配平 b、条件 c、箭号才能正确解答此题.