题目内容
【题目】子涵同学在研究二氧化碳的实验室制法时,称量了12.5g含杂质的大理石,并将其放入装有100g稀盐酸的烧杯中,恰好完全反应(杂质不与盐酸反应),他称量烧杯中物质的总质量为108.1g,则:
(1)生成二氧化碳的质量是多少________?
(2)石灰石的纯度是多少________?
【答案】4.4g 80%。
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算石灰石的纯度。
解:(1)根据质量守恒定律可知反应前后物质总质量不变,所以二氧化碳的质量为:12.5g+100g-108.1g=4.4g;
(2)设石灰石中碳酸钙的质量分数为x,
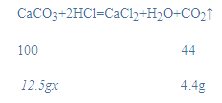
![]()
x=80%;
答:(1)生成二氧化碳的质量是4.4g;
(2)石灰石的纯度是80%。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】水是人类生命之源,是宝贵的自然资源。
(1)下列各种水中,属于纯净物的是______ (填字母)。
A.汽水 B. 矿泉水 C.蒸馏水 D. 经过净化处理的自来水
(2)蒸馏水、矿泉水、白醋、酒精都是常见的无色液体,其中白醋具有酸味,酒精具有特殊气味的是酒精,常被称为绿色能源,请写出酒精燃烧的化学方程式 _______________________________ ;在密闭容器中,将少量乙醇置于一定量氧气中燃烧,生成二氧化碳、水蒸气和一种未知物质W。现测得反应前后各物质的质量如下:
物质 | 乙醇 | 氧气 | 二氧化碳 | 水蒸气 | W |
反应前质量/g | 48 | 80 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 44 | 54 | x |
根据质量守恒定律,得出表中x的值为_______,另外两种无色液体可用多种方法区分,例如:加入 _____________ ,根据产生泡沫的多少来区分。
【题目】实验室制取氧气并进行相关实验。
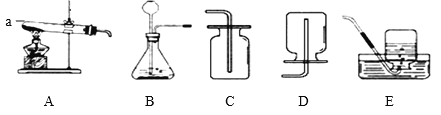
(1)用过氧化氢溶液和二氧化锰混合制氧气。下列取用二氧化锰的操作正确的是___(填字母序号)。
(2)探究带火星的木条复燃情况,部分实验数据记录如下:
氧气体积分数(%) | 30 | 40 | 60 | 70 |
带火星的木条 | 不变 | 稍亮 | 复燃 | 复燃 |
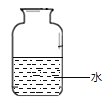
根据上述实验数据得出的结论是_________________________ 。在集气瓶中注入占其容积50%的水(如图所示),用排水法收集氧气,将瓶内的水排尽,用带火星的木条在该集气瓶中进行实验,推测实验现象并说明理由。____________________________________。