题目内容
【题目】在研究某石灰石样品(杂质不溶于水也不与盐酸反应)的活动中,兴趣小组同学进行了如下实验,过程如图所示:
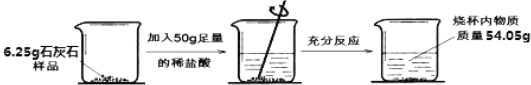
求:(1)反应中生成二氧化碳的质量是 。
(2)该大理石样品中碳酸钙的质量分数是 。
(3)100kg这种石灰石充分煅烧后,可得到固体多少kg?(碳酸钙高温分解时只生成氧化钙与二氧化碳)
【答案】(1)2.2g(2)80%(3)64.8kg。
【解析】
试题分析∶(1)反应中生成二氧化碳的质量是∶6.25g+50g-54.05g=2.2g.
⑵解∶设该大理石样品中碳酸钙的质量为xg
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 2.2g
100/x=44/2.2g得x=5g.
该大理石样品中碳酸钙的质量分数是5g/6.254g×100%=80%.
⑶解:设生成二氧化碳的质量为x
CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
100 44
100kg×80% x
100/44=(100kg×80%)/x
x=35.2kg
可得固体的质量为:100kg-35.2kg=64.8kg
答:100kg这种石灰石充分煅烧后,可得固体64.8kg。
考点∶考查质量守恒定律的应用及根据化学方程式进行计算。

练习册系列答案
相关题目
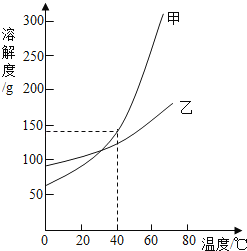
【题目】下面的表格中列出了氢氧化钠在不同温度下的溶解度:
温度(℃) | 20 | 40 | 60 | 80 |
溶解度(g) | 85 | 138 | 203 | 285 |
请问:(1)在如图的甲、乙两条溶解度曲线中,其中表示氢氧化钠溶解度曲线的是 .
(2)在20℃时,向100g水中加100g氢氧化钠,形成氢氧化钠的 (填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为 g,该溶液中溶质与溶剂的质量比为 .