题目内容
【题目】FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.
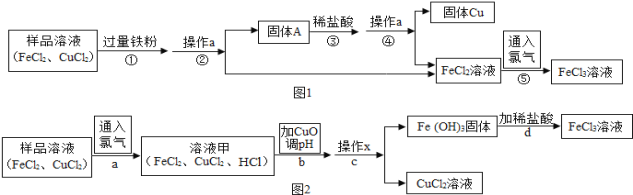
实验一:(如图1)
(1)写出步骤①中发生的化学方程式 ,此反应的基本类型是 .
(2)步骤②中的操作a名称是 ;步骤③中加入稀盐酸的目的是 .
实验二:该实验小组同学通过查阅资料,又进行了另一种尝试.
【阅读资料】不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.
如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(3)如图2,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式 ;你认为步骤b调节溶液的pH到 (数值范围)比较合适.
(4)该实验需要用pH试纸测量溶液的pH,请将pH试纸的使用方法补充完整: , ,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH.
(5)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用 (用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
【答案】(1)Fe+CuCl2=FeCl2+Cu;置换反应;(2)过滤;除去过量的铁粉;(3)2HCl+CuO=CuCl2+H2O;3.2﹣4.7;(4)在玻璃板上放一小片试纸,用玻璃棒蘸取待测液滴在pH试纸上;(5)C
【解析】
试题分析:实验一:(1)铁的活动性比铜强,因而铁和氯化铜反应产生氯化亚铁和铜,反应的方程式为:Fe+CuCl2=FeCl2+Cu,该反应是单质和化合物反应产生新的单质和新的化合物,属于置换反应;(2)步骤②中的操作是将固体和液体的分离,因此是过滤;固体A中是铁和铜的混合物,加入盐酸将铜分离出来,因此是除去过量的铁粉;实验二:(3)盐酸和氧化铜反应产生氯化铜和水,反应的方程式为:2HCl+CuO=CuCl2+H2O;根据实验目的可知,要让Fe3+沉淀完全,Cu2+不能形成沉淀,氢氧化铁沉淀完全的pH为3.2,氢氧化铜开始沉淀时的pH为4.7,要让Fe3+沉淀完全,Cu2+不形成沉淀,溶液的pH应保持在3.2~4.7之间的范围;(4)用pH试纸测量溶液的pH的方法为:在玻璃板上放一小片试纸,用玻璃棒蘸取待测液滴在pH试纸上,把显示的颜色与标准比色卡对照,读出pH;(5)盐酸能够和氢氧化铁反应不产生新的杂质,可以防止氯化铁变质产生氢氧化铁.