题目内容
【题目】为测定某石灰石中CaCO3的含量,某课外小组对其成分进行实验测定,甲、乙、丙三位同学分别进行实验,实验数据如表:
甲 | 乙 | 丙 | |
所取混合物的质量/g | 8g | 8g | 10g |
加入稀盐酸的质量/g | 80g | 100g | 80g |
反应后产生气体的质量/g | 2.2g | 2.2g | 2.2g |
(1)所取混合物与稀盐酸恰好完全反应的是同学的实验.
(2)该同学所取的混合物中碳酸钙的质量.
(3)计算该同学所取混合物与稀盐酸恰好完全反应后,所得溶液中溶质的质量分数(保留一位小数).
【答案】
(1)甲
(2)解:设乙同学所取的混合物中碳酸钠的质量为x,生成氯化钙质量为y,
CaCO3+2HCl= | CaCl2+H2O+ | CO2↑ |
10 | 111 | 44 |
X | Y | 2.2g |
![]() =
= ![]() =
= ![]()
x=5g
y=5.55g
答:所取的混合物中碳酸钙的质量5g
(3)解:恰好反应后所得溶液中溶质质量分数为: ![]() ×100%≈6.7%
×100%≈6.7%
答:恰好反应后所得溶液中溶质质量分数为6.7%
【解析】解:(1)根据甲同学的实验,8g样品与80g稀盐酸反应可生成2.2g二氧化碳;而乙同学取8g样品时,只加入100g稀盐酸也得到2.2g二氧化碳;对比两同学所取药品量及生成二氧化碳质量可知:乙同学所取稀盐酸过量,8g样品完全反应能生成二氧化碳2.2g;同样的方法对比甲、丙两同学的实验数据可知:丙同学所取样品过量,80g稀盐酸完全反应能生成二氧化碳2.2g; 综合以上分析,8g样品与80g稀盐酸恰好完全反应,生成8.8g二氧化碳;
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】根据装置图,回答相关问题: 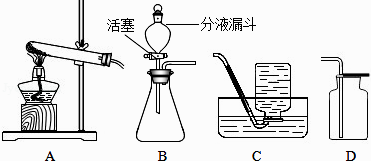
(1)若用加热氯酸钾的方法制取氧气,反应的化学方程式为;发生装置可选用图中的(填编号);收集氧气选用图中的C装置,与D装置相比,C装置的优点是:收集到的氧气 .
(2)若用分解过氧化氢溶液的方法制取氧气,发生装置可选用图中的B装置. ①若该反应用MnO2作催化剂,则MnO2应该装在B装置的(填仪器名称)中,反应的化学方程式为
②下表是分解相同浓度的过氧化氢溶液时选用不同催化剂所得到的实验数据:
催化剂(质量均为0.3g) | 新鲜猪肝 | CuCl2 | MnO2 | CuO |
收集1L氧气所需的时间(s) | 42 | 650 | 18 | 300 |
从上述数据可得出一个结论: .
【题目】一定条件下,在一个密闭器内发生某反应,测得反应前后各物质的质量如下表所示,下列说法正确的是( )
物质 | W | O2 | H2O | CO2 |
反应前质量(g) | 23 | 58 | 5 | 6 |
反应后质量(g) | 0 | 10 | 32 | X |
A. X的值为44
B. W是一种由碳、氢两种元素组成的化合物
C. W是一种由碳、氢、氧三种元素组成的化合物
D. 该反应属于化合反应