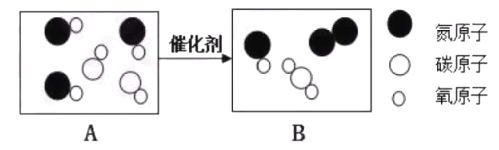
题目内容
【题目】海水晒制粗盐的主要成分为NaCl,还含有少量的MgCl2、CaCl2、Na2SO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:
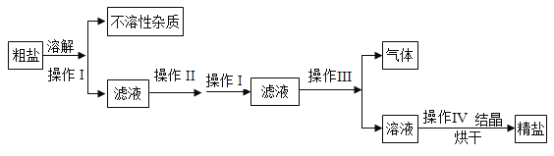
请分析上面流程图示,回答:
(1)操作Ⅰ的名称为_____,与操作Ⅳ都要用到的玻璃仪器的名称为____,该仪器在操作Ⅰ中的作用是____。
(2)为除去MgCl2、CaCl2、Na2SO4可溶性杂质,操作Ⅱ中依次加入的物质(过量)和顺序NaOH、BaCl2、Na2CO3,加入过量Na2CO3的目的是___;
(3)为获取较纯净精盐,在操作Ⅲ中要加入适量的试剂是_____。
【答案】过滤 玻璃棒 引流 除去CaCl2和BaCl2 稀盐酸
【解析】
(1)操作Ⅰ的名称为过滤,与操作Ⅳ都要用到的玻璃仪器的名称为玻璃棒,玻璃棒在过滤中的作用是引流;
(2)为除去MgCl2、CaCl2、Na2SO4可溶性杂质,操作Ⅱ中依次加入的物质(过量)和顺序是NaOH、BaCl2、Na2CO3,加入过量Na2CO3的目的是除去CaCl2和BaCl2;
(3)为获取较纯净精盐,在操作Ⅲ中要加入适量的试剂是稀盐酸。

【题目】某兴趣小组的同学对一包久置的生石灰(CaO)干燥剂产生了好奇,于是他们对这包干燥剂的成分展开了探究。
(提出问题)这包干燥剂是否变质,成分是什么?
(猜想假设)猜想一:全部是CaO;
猜想二:是CaO和Ca(OH)2的混合物;
猜想三:全部是Ca(OH)2;
猜想四:是Ca(OH)2和CaCO3的混合物;
猜想五:全部是CaCO3。
(实验探究)(1)取部分该干燥剂于试管中,加水后无放热现象,说明这包干燥剂中不含_________。
(2)继续向试管中滴加足量稀盐酸,有气泡出现,说明这包干燥剂中含有___。
(3)为了进一步确定这包干燥剂中有无其他成分,小组同学设计了以下三种方案。
另取部分干燥剂于烧杯中,加水并搅拌,静置后取上层清液于3支试管中。请你参与实验,并填写表中的空白:
实验方案 | 方案一 | 方案二 | 方案三 |
实验操作 |
|
|
|
实验现象 | 溶液由无色变红色 | 澄清溶液变浑浊 | 产生蓝色沉淀 |
写出方案三发生的化学反应方程式________。
(实验结论)通过以上实验探究,得出猜想________成立。
(拓展迁移)小组同学反思了生石灰干燥剂变质的原因,认识到实验室保存氧化钙应注意________。
【题目】某实验小组在探究碱的化学性质实验时,用到了氢氧化钠溶液和氢氧化钙溶液。
(1)甲同学不小心将这两种溶液混合在一起,结果产生__________的现象,说明氢氧化钠溶液变质了。写出变质时发生反应的化学方程式____________。
(2)同学们对变质的氢氧化钠溶液中溶质的成分产生了兴趣,进行如下探究:
(提出问题)氢氧化钠溶液中溶质的成分是什么?
(做出猜想)猜想一:Na2CO3
猜想二:___________(写化学式)
(进行讨论)甲同学取少量待测液加入足量的稀盐酸,有气泡产生,认为猜想一成立。乙同学不同意甲同学的观点,理由是_______。
(设计实验)请你验证猜想二成立,并完成实验报。
实验操作 | 实验现象 | 实验结论 |
①取一定量的待测液于试管中,加入___________溶液。 ②充分反应后静置,取上层淸液加入无色酚酞溶液 | ________ | 猜想二成立 |