题目内容
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶气体是①CO、O2 ②CO2、CH4③NO2、O2 ④N2、H2( )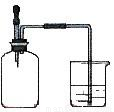
A.①②
B.②④
C.③④
D.②③
【答案】分析:二氧化碳大家比较熟悉,能溶于水,可使瓶内压强变小,所以答案中必有②,而N2、H2皆难溶于水,且相互间不反应,从而快速选出D.还可依据装置设计原理进行解题:烧杯中水进入集气瓶的原因是存在压强差;当气体能与液体反应或溶于液体时,造成瓶内部压强变小,从而使烧杯中的水进入集气瓶.
解答:解:①CO、O2 二者相互间无点燃条件不反应且一氧化碳不溶于水,氧气难溶于水,故不符合题意;
②二者不反应,CO2能溶于水,可造成瓶内压强变小,水进入,CH4难溶于水;
③NO2、O2 和水可以发生化学反应生成硝酸,使瓶内压强变小;
④N2化学性质比较稳定,二者不反应,并且N2、H2都难溶于水,所以滴加水压强变化不大.
故选D.
点评:本题主要考查了教材中常见气体的物理、化学性质,比较简单.
解答:解:①CO、O2 二者相互间无点燃条件不反应且一氧化碳不溶于水,氧气难溶于水,故不符合题意;
②二者不反应,CO2能溶于水,可造成瓶内压强变小,水进入,CH4难溶于水;
③NO2、O2 和水可以发生化学反应生成硝酸,使瓶内压强变小;
④N2化学性质比较稳定,二者不反应,并且N2、H2都难溶于水,所以滴加水压强变化不大.
故选D.
点评:本题主要考查了教材中常见气体的物理、化学性质,比较简单.

练习册系列答案
相关题目
某班化学兴趣小组同学,在对氧气性质进行研究时,设计了如下实验:
(1)用排水法将集满氧气的两个集气瓶如图所示放置,并分别同时迅速插入一根带火星的木条,发现木条均复燃,且甲中燃烧比乙中更旺,该实验说明氧气具有的性质是:①______,②______.
(2)带火星的木条在氧气中可以复燃.那么,是不是只有纯净的氧气才能使带火星的木条复燃呢?为此,同学们开展了相关探究实验.实验主要步骤如下:先制取一定量的氧气备用,再测得集气瓶实际容积为317毫升,然后采用某种方法得到5瓶含氧量不同的空气,最后用带火星的木条来试验,观察是否复燃.相关的数据见下表:
①请指出得到5瓶含氧量不同的空气的具体方法______;
②试将上表空白处补充完整(保留1位小数);
③由该实验可得到的结论是______.
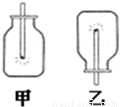
(1)用排水法将集满氧气的两个集气瓶如图所示放置,并分别同时迅速插入一根带火星的木条,发现木条均复燃,且甲中燃烧比乙中更旺,该实验说明氧气具有的性质是:①______,②______.
(2)带火星的木条在氧气中可以复燃.那么,是不是只有纯净的氧气才能使带火星的木条复燃呢?为此,同学们开展了相关探究实验.实验主要步骤如下:先制取一定量的氧气备用,再测得集气瓶实际容积为317毫升,然后采用某种方法得到5瓶含氧量不同的空气,最后用带火星的木条来试验,观察是否复燃.相关的数据见下表:
| 集气瓶编号 | 瓶内预装水 体积/毫升 | 充入氧气 体积/毫升 | 瓶内空气 体积/毫升 | 瓶内空气里氧气 体积的百分比 | 木条能否 复燃 |
| 1 | 120 | 120 | 197 | 50.9% | 能 |
| 2 | 97 | 97 | 220 | ______% | 能 |
| 3 | 90 | 90 | 227 | 43.4% | 能 |
| 4 | 84 | 84 | 233 | 41.9% | 能 |
| 5 | 81 | 81 | 236 | 41.2% | 不能 |
②试将上表空白处补充完整(保留1位小数);
③由该实验可得到的结论是______.

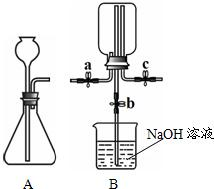 32、甲、乙两小组同学分别用如图所示装置(夹持仪器已略去)做兴趣实验.
32、甲、乙两小组同学分别用如图所示装置(夹持仪器已略去)做兴趣实验.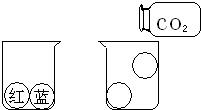 27、如图所示,在大烧杯中,有红、蓝两只彩色气球,红色气球内充有二氧化碳(CO2)气体,蓝色气球内充有空气,两只气球沉在杯底.小明同学收集好一集气瓶CO2气体,倾倒入大烧杯中,发现其中一只气球浮起来了,用手轻轻将其按下,手一松气球又重新上浮,十分有趣.
27、如图所示,在大烧杯中,有红、蓝两只彩色气球,红色气球内充有二氧化碳(CO2)气体,蓝色气球内充有空气,两只气球沉在杯底.小明同学收集好一集气瓶CO2气体,倾倒入大烧杯中,发现其中一只气球浮起来了,用手轻轻将其按下,手一松气球又重新上浮,十分有趣. 某班化学兴趣小组同学,在对氧气性质进行研究时,设计了如下实验:
某班化学兴趣小组同学,在对氧气性质进行研究时,设计了如下实验: