题目内容
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)下列各项中,在化学反应前后一定改变的是_______(填序号,多选、少选错选、均不给分)
①元素种类 ②物质的种类 ③原子的种类 ④分子种类 ⑤原子数目
(2)已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),
小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1<m2,其原因是____。该反应______ (填“符合”或“不符合” ) 质量守恒定律
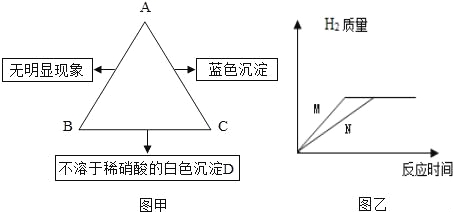
(3)下图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子:
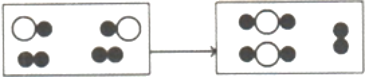
由![]() 聚集成的物质________(填“可能”或“不可能” )是氧化物, 参加反应的两种反应物的分子个数比为_____,此反应的基本反应类型为____。
聚集成的物质________(填“可能”或“不可能” )是氧化物, 参加反应的两种反应物的分子个数比为_____,此反应的基本反应类型为____。
(4)下列是初中化学中常见的实验。相关说法错误的是(填序号____)
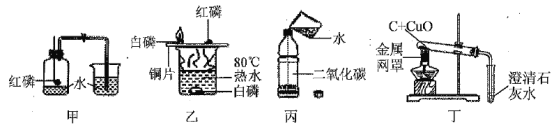
①甲实验的目的是测定空气中氧气的含量
②乙实验,水中的白磷没有燃烧,是因为温度没有达到着火点
③丙实验加水后,立即旋紧瓶盖,振荡,看到的现象是软塑料瓶向内凹陷
④丁实验,酒精灯上放的金属网罩是为了提高温度
【答案】②④ 反应生成的氧化镁部分扩散到空气中 符合 可能 2:1 化合反应 ②
【解析】
(1)在化学变化中,根据质量守恒定律,元素种类、原子的种类、原子数目一定不变;化学变化中一定有新物质生成,所以物质的种类、分子种类一定改变。故选②④;
(2)小西在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因是反应生成的氧化镁部分扩散到空气中;由于没有将扩散到空气中的氧化镁计算在内,出现上述的实验结果,质量守恒定律适用于所有的化学反应,该反应符合质量守恒定律;
(3)根据“![]() ”可知,该物质的微粒是由两不种的原子构成,即该物质是由两种元素组成,其中一种元素可能是氧元素,所以聚集成的物质可能是氧化物;
”可知,该物质的微粒是由两不种的原子构成,即该物质是由两种元素组成,其中一种元素可能是氧元素,所以聚集成的物质可能是氧化物;
根据微观模拟图可知,参加反应的物质中有1个“![]() ”没有参加反应,参加反应的两种反应物的分子个数比为2:1,该反应中反应物是两种,生成物是一种,属于化合反应;
”没有参加反应,参加反应的两种反应物的分子个数比为2:1,该反应中反应物是两种,生成物是一种,属于化合反应;
(4)①红磷是固体,能在空气中燃烧,且生成物五氧化二磷是固体,可以用来测定空气中氧气含量,故①正确;
②乙实验,水中的白磷没有燃烧,是因为没有氧气,故②错误;
③丙实验加水后,立即旋紧瓶盖,振荡,二氧化碳易溶于水,瓶内气压变小,软塑料瓶向内凹陷,故③正确;
④酒精灯上放的金属网罩是为了提高温度,故④正确。故选②。

 备战中考寒假系列答案
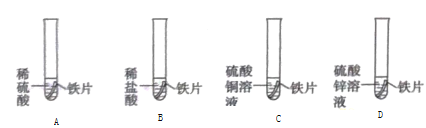
备战中考寒假系列答案【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
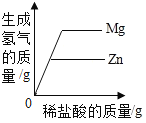
A.足量红磷在密闭容器中燃烧 | B.常温下,稀释KOH 溶液 | C.向等质量的Mg和Zn中分别加入等质量等浓度的稀盐酸 | D.将铁钉加入一定量的硫酸铜溶液中 |
A. A B. B C. C D. D
【题目】铁与水蒸气在高温条件下反应生成一种铁的氧化物和一种气体单质,实验装置如图所示。

(1)试管尾部放一团湿棉花的目的是_____。
(2)用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到上方空中,说明生成的气体是_____。
(3)探究试管中剩余固体成分。
(查阅资料)①几种常见铁的氧化物的颜色、状态及能否被磁铁吸引如下表所示。
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
②四氧化三铁能与稀硫酸反应:Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(初步实验验证)试管中剩余固体为黑色,能全部被磁铁吸引,则剩余固体一定不含的铁的氧化物是_____、_____ 。
(猜想与假设)猜想一:剩余固体是Fe3O4;猜想二:剩余固体是_____ 。
(继续进行实验)
实验操作 | 实验现象 | 实验结论 |
取少量黑色固体于试管中,滴加足量的稀硫酸。 | _____ | 猜想二成立。 |
(实验结论)铁和水蒸气反应的化学方程式为_____。