题目内容
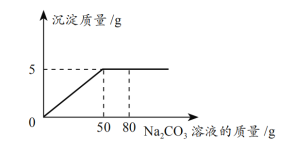
【题目】在CaCl2和NaCl的10g混合物中加入一定量的水,全部溶解得到50g混合溶液,向该溶液中逐滴加入一定浓度的Na2CO3溶液,生成沉淀质量与加入Na2CO3溶液的质量关系如图所示,计算:
(1)混合物中CaCl2的质量分数是多少? _______
(2)所加Na2CO3溶液的质量分数是多少?________
【答案】55.5% 10.6%
【解析】
(1)钙离子与碳酸根离子反应生成碳酸钙沉淀,而碳酸钙中钙来源于氯化钙中的钙,所以根据钙元素质量守恒,氯化钙中钙元素质量=碳酸钙中钙元素质量,设氯化钙的质量为m,
m×氯化钙中钙元素质量分数=碳酸钙质量×碳酸钙中钙元素质量
m×![]() ,m=5.55g
,m=5.55g
混合物中氯化钙质量分数=![]() ;
;
(2)从图中信息可知,加入50g碳酸钠溶液,与氯化钙全部反应生成了5g碳酸钙沉淀,因此设反应消耗掉碳酸钠质量为n,
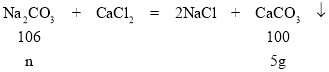
![]() n=5.3g
n=5.3g
碳酸钠溶液质量分数=![]() 。
。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目