题目内容
如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时 U 形管中甲端液面下降,乙端液面上升.
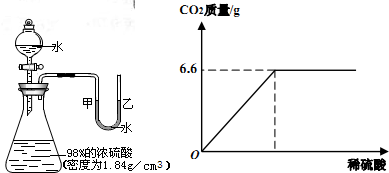
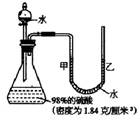
这个实验说明了________、________,这个事实告诉我们为了防止发生事故,在稀释浓硫酸时,一定要________(叙述正确的操作),某同学从制碱厂带回一瓶废弃的纯碱样品,决定测定其中碳酸钠的质量分数(假设该样品中只含有氯化钠一种杂质).她取样品30g逐滴加入上述稀硫酸,生成 CO2 气体的质量与滴加稀硫酸的质量关系如上图所示,求:样品中碳酸钠的质量分数.(计算结果用百分数表示,保留到小数点后一位数字)
浓硫酸遇水溶解放出大量的热 密度比水大 将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散
分析:根据“浓硫酸遇水溶解放出大量的热”的性质,分析产生上述现象的原因.并可得实验室稀释浓硫酸的方法:将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散.
根据生成CO2气体的质量与滴加稀盐酸的质量关系图可知,恰好完全反应时,生成二氧化碳气体的质量为6.6g,根据二氧化碳气体的质量可计算参加反应的碳酸钠的质量,进而计算出样品中碳酸钠的质量分数.
解答:分析产生上述现象的原因为:浓硫酸遇水溶解放出大量的热,密度比水大,使浮在浓硫酸上面的水立即沸腾,造成液滴飞溅;所以实验室稀释浓硫酸的方法是:将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散.
设样品中碳酸钠的质量为x.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 6.6g
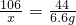
x=15.9g
样品中碳酸钠的质量分数为: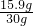 ×100%=53.0%
×100%=53.0%
故答案为:浓硫酸遇水溶解放出大量的热;密度比水大;将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散;样品中碳酸钠的质量分数为53%;
点评:本题难度不是很大,理解题意、抓住“三点一趋势”(起点、拐点、终点和图象的变化趋势)、分析图象中所给数据的含义、正确的运用有关数据解决问题是解答此类题目的关键所在.
分析:根据“浓硫酸遇水溶解放出大量的热”的性质,分析产生上述现象的原因.并可得实验室稀释浓硫酸的方法:将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散.
根据生成CO2气体的质量与滴加稀盐酸的质量关系图可知,恰好完全反应时,生成二氧化碳气体的质量为6.6g,根据二氧化碳气体的质量可计算参加反应的碳酸钠的质量,进而计算出样品中碳酸钠的质量分数.
解答:分析产生上述现象的原因为:浓硫酸遇水溶解放出大量的热,密度比水大,使浮在浓硫酸上面的水立即沸腾,造成液滴飞溅;所以实验室稀释浓硫酸的方法是:将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散.
设样品中碳酸钠的质量为x.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 44
x 6.6g
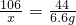
x=15.9g
样品中碳酸钠的质量分数为:
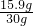 ×100%=53.0%
×100%=53.0%故答案为:浓硫酸遇水溶解放出大量的热;密度比水大;将浓硫酸沿器壁慢慢地倒入水中,并不断地用玻璃棒搅拌,使热量迅速扩散;样品中碳酸钠的质量分数为53%;
点评:本题难度不是很大,理解题意、抓住“三点一趋势”(起点、拐点、终点和图象的变化趋势)、分析图象中所给数据的含义、正确的运用有关数据解决问题是解答此类题目的关键所在.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
 14、如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.这个实验说明了
14、如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.这个实验说明了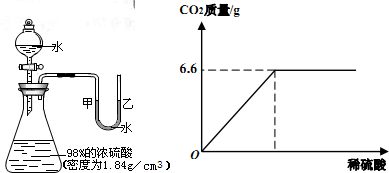
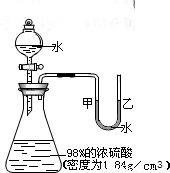 如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.
如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.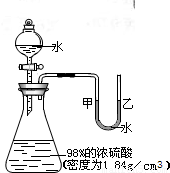 如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.
如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.