题目内容
【题目】某化学兴趣小组为了测定石灰石中碳酸钙的含量,取10.0g石灰石样品(样品中的杂质不与稀盐酸反应),经粉碎后全部放入烧杯中,并加入足量的稀盐酸,烧杯及所盛物质的总质量为80.0g。反应过程中测得烧杯及所盛物质的质量与相应时间记录如下表:
反应时间/分 | 0 | 2 | 4 | 6 | 8 | 10 |
烧杯及所盛物质质量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
试计算:(1)反应结束后,共放出多少克的二氧化碳?
(2)该石灰石样品中碳酸钙的质量分数是多少?
【答案】(1)2.2g.(2)50%
【解析】请在此填写整体分析!
【1】(1)由表可知,反应后剩余固体的质量为77.8g,故生成二氧化碳的质量为80g-77.8g=2.2g;
【2】(2)设生成2.2g的二氧化碳需要碳酸钙的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 44
x 2.2g
![]() =
=![]() ,解得x=5g,样品中碳酸钙的质量分数为
,解得x=5g,样品中碳酸钙的质量分数为![]() ×100%=50%。
×100%=50%。
答;共生成二氧化碳的质量为2.2g,样品中碳酸钙的质量分数为50%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
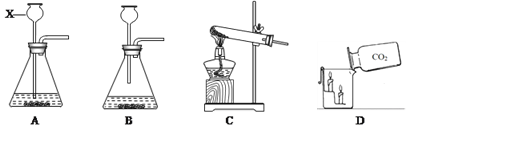
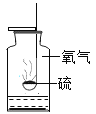
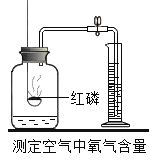
【题目】对下列实验指定容器中的水,其解释没有体现水的主要作用的是
A | B | C | D | |
实验装置 |
|
|
|
|
解释 | 集气瓶中的水:吸收放出的热量 | 量筒中的水:通过水体积的变化得出O2体积 | 集气瓶中的水:冷却溅落融熔物,防止集气瓶炸裂 | 集气瓶中的水:水先将集气瓶内的空气排净,后便于观察O2何时收集满 |
A.AB.BC.CD.D