��Ŀ����
��֪���ᣨH2C2O4��������Ũ���Ṳ�ȷ�����ѧ��Ӧ��H2C2O4 CO2��+CO��+H2O��ij��ѧ��ȤС���������ʵ��װ�ã�������ȡ���������CO��������ԭ���������������ĿҪ��ش��������⣺
CO2��+CO��+H2O��ij��ѧ��ȤС���������ʵ��װ�ã�������ȡ���������CO��������ԭ���������������ĿҪ��ش��������⣺
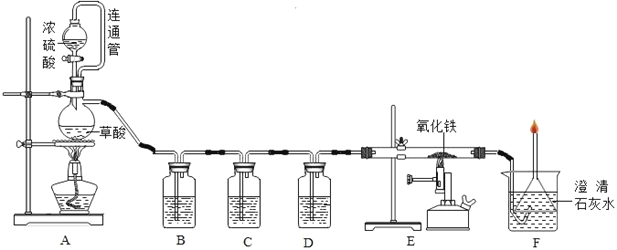
��1����װ��ͼ��װ��ʵ��������ʵ��ǰ����Ҫ_____����ȼE���ƾ���ǰ����_____��
��2��װ��B�е��Լ���_____��Һ����Ӧ�Ļ�ѧ����ʽΪ_____��װ��C����ʢ��Һ����_____����������_____��
��3��Eװ�ò������й۲쵽��������_____����Ӧ�Ļ�ѧ����ʽΪ_____��
��4��Aװ������ͨ�ܵ�������_____��
��5��Fװ�õ�������_____��_____��ֻ��������ɣ���
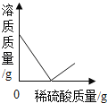
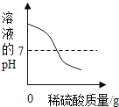
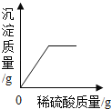
��6����������װ�û����Բⶨ��������Ʒ��������������������ijͬѧ�IJⶨ�����ǣ�������������Ʒ10.0 g��Eװ���в���������Ʒ��������Ϊ80.0 g����ȫ��Ӧ����ȴ���ٳ���Eװ���в�������ʣ������������Ϊ78.2 g���ɸ�ʵ��ɼ������������Ʒ������������������Ϊ_____��
�Կ�ȸʯΪԭ����ȡ������CuSO4?5H2O���IJ��ֹ���������ͼ��ʾ��

���������ϣ�
I����ȸʯ��Ҫ�ɷ�ΪCu2��OH��2CO3����������SiO2��������ˮ������ϡ���ᷴӦ����Fe2O3�����ʡ�
������һ����ɫ���壬�����ֽ⡣
���ڸ�ʵ�������£�Fe��OH��3��Cu��OHI��2������pH���±���
Fe��OH��3 | Cu��OH��2 | |
��ʼ������pH | 1.14 | 4.2 |
��ȫ������pH | 3.0 | 6.7 |
��1������1������Ϊ_____��ʵ���ҽ��иò���ʱ��������������_____��
��2������a����CaCO3��ͬʱ������NH4C1���÷�Ӧ�Ļ�ѧ����ʽΪ_____��
��3����Һc�е������У�CuSO4��H2SO4��_____��д��ѧʽ��
��4��Ϊ����Һ�е�Fe3+ȫ��ת��ΪFe��OH��3��������Cu2+��ת��ΪCu��OH��2������Ӧ����pH��m��m�ķ�Χ��_____��
��5����õ�������ʱ���ý��½ᾧ�����������ᾧ����Ҫԭ����_____��