题目内容
 某实验小组为了测定人体呼出的气体中CO2的体积分数,设计如下实验:
某实验小组为了测定人体呼出的气体中CO2的体积分数,设计如下实验:(1)搜集5L某同学呼出的气体样品,
(2)在气体样品中加入过量的澄清石灰水,振荡,充分反应,
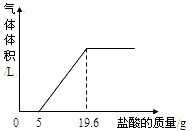
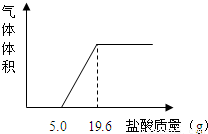
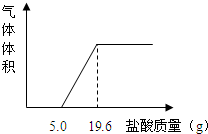
(3)把反应后的溶液转移到烧杯中,慢慢滴入质量分数为5%的稀盐酸,到不再产生气泡为止,产生气体的体积与加入盐酸的质量关系如图.
回答下列问题:
(1)加入5.0g稀盐酸没有气泡产生,原因是(用化学方程式表示):
(2)加入稀盐酸产生CO2的中质量是多少?(溶于水中的CO2忽略不计)
(3)该气体样品中CO2的体积分数是多少?(常温下的密度为1.96g/L)
分析:(1)根据图象可知,稀盐酸先和过量的澄清石灰水反应,再和碳酸钙反应,并能看出和这两种物质反应的稀盐酸的质量;
(2)根据参与反应的稀盐酸中氯化氢的质量,根据反应的化学方程式就可求出生成二氧化碳的质量.
(3)根据二氧化碳的密度和质量可以求出二氧化碳的体积,进而求出体积分数.
(2)根据参与反应的稀盐酸中氯化氢的质量,根据反应的化学方程式就可求出生成二氧化碳的质量.
(3)根据二氧化碳的密度和质量可以求出二氧化碳的体积,进而求出体积分数.
解答:解:(1)由于酸首先和碱发生反应,所以加入5g盐酸前没有产生气体,故答案为:Ca(OH)2+2HCl=CaCl2+2H2O
(2)设:产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
(19.6g-5g)×5% x
=
x=0.44g
(3)二氧化碳的体积为:
=0.22L
气体样品中CO2的体积分数为:
×100%=4.4%.
答:该气体样品中CO2的体积分数是4.4%.
故答案为:(1)Ca(OH)2+2HCl=CaCl2+2H2O;(2)0.44g;(3)4.4%.
(2)设:产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
(19.6g-5g)×5% x
| 73 |
| (19.6g-5g)×5% |
| 44 |
| x |
x=0.44g
(3)二氧化碳的体积为:
| 0.44g | ||
|
气体样品中CO2的体积分数为:
| 0.22L |
| 5L |
答:该气体样品中CO2的体积分数是4.4%.
故答案为:(1)Ca(OH)2+2HCl=CaCl2+2H2O;(2)0.44g;(3)4.4%.
点评:本题难度不是很大,主要考查了图象和数据地分析及根据化学方程式进行计算,培养学生的分析能力和解决问题的能力.

练习册系列答案
相关题目

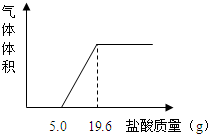 某实验小组为了测定人体呼出的气体中CO2的体积分数,设计如下实验:
某实验小组为了测定人体呼出的气体中CO2的体积分数,设计如下实验: