题目内容
【题目】研究物质的溶解对于生产、生活有着重要意义。下表是硝酸钾的部分溶解度数据。
温度/℃ | 0 | 20 | 40 | 60 | 80 |
溶解度/g | 13.3 | 31.6 | 63.9 | 110 | 169 |
(1)硝酸钾溶液中的溶剂是 ___。
(2)硝酸钾的溶解度随温度升高而___。(选填“增大”、 “减小”、“基本不变”)。
(3)60℃时硝酸钾饱和溶液 210g,升温到 80℃后,溶质与溶剂的质量比为___。再降温到 20℃,析出 硝酸钾晶体的质量___。
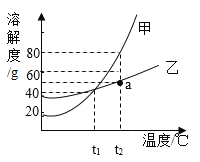
(4)20℃时,向一定质量的硝酸钾中分批加水,充分搅拌,现象如图 所示:

下列坐标图中的描点,可能符合实验结果的是(_________)

【答案】水 增大 11:10 78.4g bd
【解析】
答题空1:在溶液中,能溶解其他物质的物质叫溶剂,硝酸钾溶液中的溶剂是水;
答题空2:读硝酸钾的部分溶解度数据表可知,随着温度升高,硝酸钾的溶解度增大;
答题空3:读硝酸钾的部分溶解度数据表可知,60度时硝酸钾的溶解度为110g,所以在210克饱和硝酸钾溶液中溶剂的质量为100g,溶质质量为110g,当升温到80℃后,硝酸钾溶解度升高,溶质、溶剂的质量未发生变化,溶质溶剂的质量比为110:100=11:10;
答题空4:读硝酸钾的部分溶解度数据表可知,60度时硝酸钾的溶解度为110g,所以在210克饱和硝酸钾溶液中溶剂的质量为100g,溶质质量为110g,当降温至20℃后,硝酸钾溶解度为31.6g,析出晶体质量为110g-31.6g=78.4g;
答题空5:溶质质量分数是溶液中溶质质量与溶液质量之比,在前面两次加水后瓶中有未溶解固体,说明是饱和溶液,因此溶质质量分数相同,第三次继续加水后固体全部溶解,溶液可能恰好达到饱和,这时溶质质量分数与前两次相同,也可能溶液变得不饱和,溶质质量分数减小,继续加25g水,溶液质量增加,溶质质量不变,溶质质量分数减小。
故选bd。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】某同学为了测定石灰石中钙元素的含量(假设石灰石中除CaCO3含钙元素外,杂质不含钙元素、且不溶于水、不与酸反应),进行如下实验:称取20g石灰石样品放入烧杯中,将80g稀盐酸分4等份,分4次加入烧杯中,充分反应后称量。所得数据如下:
次 数 | 1 | 2 | 3 | 4 |
每次加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
充分反应后烧杯中物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)充分反应后共生成CO2的质量为__________g。
(2)求样品中含CaCO3的质量_______(列化学方程计算)。
(3)该石灰石中钙元素的质量分数为____________。
【题目】如图,A、B、C是气体发生装置,D、E是气体收集装置。请回答问题:
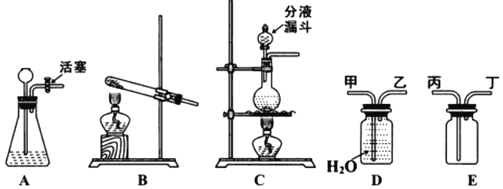
(1)参考示例,利用所学知识完成如表。
气体 | 反应物及反应条件 | 发生装置 | 收集装置及进气口 |
O2 | KMnO4固体,加热 | B | 收集:D,进气口:乙 |
CO2 | 大理石和_____,常温 | _____ | 收集:E,进气口:_____ |
N2 | NH4Cl与NaNO2饱和溶液,加热 | _____ | 收集:D,进气口:_____ |
(2)写出加热KMnO4制取O2的化学方程式_____,现收集到16g O2,则参加反应的KMnO4的质量是_____g。
(3)检查A装置的气密性:连接好装置,从长颈漏斗中加入一定量的热水,使长颈漏斗下端管口浸没在液面以下,迅速关闭活塞,如果观察到_____,说明气密性良好。