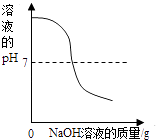
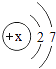��Ŀ����
����Ŀ��ijͬѧ�Ӷ����Ƕ��о�˫��ˮ��ȡ�����Ĺ��̣���ԭʵ����в��ָ��죬�����˳������������������ǣ�
��ȡ68��˫��ˮ�������Ķ������̷������巢��װ�ã����Է�Ӧǰ��������������г���������˫��ˮ�ֽ���ȫ������ȫ���ݳ�����
�ڵ�����ȫ���ݳ����ٴγ�������������
ʵ�����ݼ�¼���£�
Ӧǰ�������� | ��Ӧ�������� |
78.3g | 75.1g |
��1���������ݿ�֪�ù����й��ų������ˣ�
��2�������ż����˫��ˮ���ʵ���������.
���𰸡�
��1��3.2
��2��������3.2g������Ҫ˫��ˮ������Ϊx
2H2O2 |
| 2H2O | + | O2�� |
68 | 32 | |||
x | 3.2g |
![]() =
= ![]()
x=6.8g
����˫��ˮ���ʵ���������Ϊ�� ![]() ��100%=10%
��100%=10%
�𣺹���������Һ������Ϊ34g��
10%
���������⣺��1�����������غ㶨�ɣ���Ӧǰ���ʵ������ܺ͵��ڷ�Ӧ�����ʵ������ܺͣ���������������Ϊ��78.3g��75.1g=3.2g��
���Դ��ǣ���1��3.2����2����˫��ˮ���ʵ���������Ϊ10%��
�����㾫�������ո��ݻ�ѧ��Ӧ����ʽ�ļ����ǽ����ĸ�������Ҫ֪�������ʼ�������=ϵ������Է�������֮�ȣ�

��ϰ��ϵ�д�
 Сѧ������ҵϵ�д�
Сѧ������ҵϵ�д� ��ʿһ��ȫͨϵ�д�
��ʿһ��ȫͨϵ�д�
�����Ŀ