题目内容
【题目】下列图形能正确反映实验变化关系的是( )
A.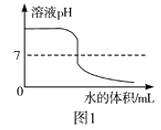 图1:向一定量4%的NaOH溶液中不断加水
图1:向一定量4%的NaOH溶液中不断加水
B. 图2:向一定量的NaOH溶液中逐滴加入稀盐酸至过量
图2:向一定量的NaOH溶液中逐滴加入稀盐酸至过量
C.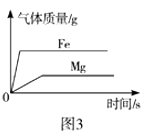 图3:常温下,将等质量的铁和镁分别同时投入足量等质量分数的稀盐酸中
图3:常温下,将等质量的铁和镁分别同时投入足量等质量分数的稀盐酸中
D.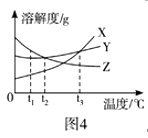 图4:将t3℃时X、Y、Z三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为Y>Z>X
图4:将t3℃时X、Y、Z三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为Y>Z>X
【答案】D
【解析】稀释氢氧化钠溶液时,溶液碱性减弱,pH减小,但是不能减小到7,更不能小于7,A错误;向一定量的NaOH溶液中逐滴加入稀盐酸至过量时,氢氧化钠和稀盐酸反应生成氯化钠和水,随着反应进行,氯化钠质量分数增大,当完全反应后,继续加入稀盐酸时,不再有氯化钠生成,此时相当于对氯化钠溶液进行了稀释,氯化钠质量分数会逐渐减小,B错误;常温下,将等质量的铁和镁分别同时投入足量等质量分数的稀盐酸中时,镁和稀盐酸的反应速率较快,反应需要时间短,并且最终镁和稀盐酸反应生成的氢气多,C错误;降温到t1℃时,X、Y仍然是饱和溶液,Y的溶解度大于X的溶解度,因此Y的质量分数大于X的质量分数,由于X在t1℃时的溶解度小于Z在t3℃时的溶解度,因此降温到t1℃时,Z的质量分数大于X的质量分数,所得溶液中溶质的质量分数由大到小的顺序为Y>Z>X,D正确.
本题选D.
【考点精析】认真审题,首先需要了解溶质的质量分数、溶解性和溶解度的关系(溶质质量分数 =溶质质量/溶液质量*100% ;溶解度=溶质质量/溶剂质量*100g (必须选取饱和溶液);溶液质量=溶质质量(克)+溶剂质量(克) ;对于饱和溶液,溶液质量分数w = S/(S+100);所以溶解度S = 100/(1/w-1)),还要掌握金属材料的选择依据(黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属)的相关知识才是答题的关键.

 名校课堂系列答案
名校课堂系列答案