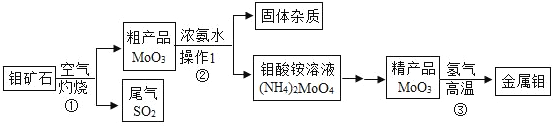
题目内容
【题目】现有含铁和锌的样品 12.1g,加入到 200g 质量分数为 10%的稀盐酸中充分反应,反应后得到211.7g 溶液,则样品中铁的质量为( )
A.2.8gB.5.6gC.6.5gD.8.4g
【答案】B
【解析】
将含铁和锌的样品,加入到稀盐酸中,铁与稀盐酸反应生成氯化亚铁和氢气,锌与稀盐酸反应生成氯化锌和氢气,反应生成的氢气的质量为:12.1g+200g-211.7g=0.4g,根据质量守恒定律,化学反应前后,元素的质量不变,反应生成氢气的质量等于参加反应的HCl中氢元素的质量,则参加反应的HCl的质量为:![]() ,14.6g<200g×10%=20g,故稀盐酸过量,铁和锌已经完全反应,设样品中铁的质量为x,反应生成氢气的质量为m,则锌的质量为:12.1g-x。锌与稀盐酸反应生成氢气的质量为0.4g-m
,14.6g<200g×10%=20g,故稀盐酸过量,铁和锌已经完全反应,设样品中铁的质量为x,反应生成氢气的质量为m,则锌的质量为:12.1g-x。锌与稀盐酸反应生成氢气的质量为0.4g-m

![]() x=28m
x=28m
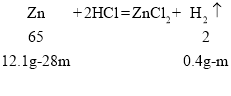
![]() m=0.2g
m=0.2g
故样品中铁的质量为28×0.2g=5.6g
故选B。

【题目】探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
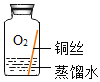
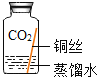
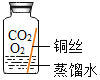
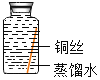
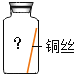
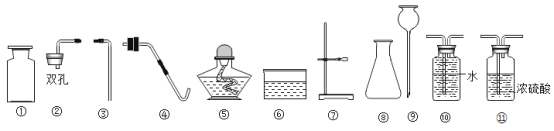
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如下图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与O2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验①和③,得出的结论是_____。
(4)为验证猜想,实验⑤广口瓶中除铜丝外,还应有的物质是_____。
(5)由上述实验可推知,铜生锈的条件是_____。
(反思与应用)
(6)结合上述实验,你对保存铜制品的建议是_____。
【题目】能源与环境已成为人们日益关注的问题。
(1)目前人们常用能源是煤、_____和天然气等化石燃料。
(2)充分燃烧1kg天然气和煤产生的CO2和SO2气体质量如图所示,下列有关说法正确的是_____。
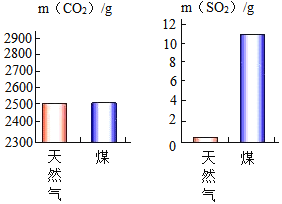
A 煤和天然气的燃烧都不会导致酸雨
B 该天然气中不含硫元素
C 煤和天然气的燃烧都有温室气体产生
D 煤燃烧对环境污染较小
(3)军运会火炬使用的燃料为A物质,A物质在B物质中完全燃烧,发生反应A+5B![]() 3C+4D(部分微观示意图如图所示)。
3C+4D(部分微观示意图如图所示)。
物质 | A | B | C | D |
|
分子示意图 | ? |
|
|
|
①该反应的化学方程式_____。
②A物质和B物质参加反应的质量比_____。(填最简整数比)
③已知反应前后有元素化合价改变的化学反应是氧化还原反应,元素化合价升高的反应物在反应中作为还原剂被氧化,元素化合价降低的反应物在反应中作为氧化剂被还原。该反应中作为还原剂的物质是_____。