题目内容
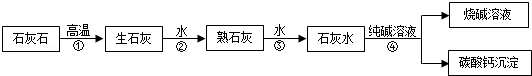
热水瓶胆水垢的主要成分是Mg(OH)2和CaCO3,可用适量盐酸清洗除去.小红为测定水垢中碳酸钙的质量分数,进行了如下实验:取200g水垢,往其中逐滴加入足量的稀盐酸,将产生的气体缓缓通入足量氢氧化钠溶液中,同时测量8min内氢氧化钠溶液质量的变化值.所得结果如下表所示(忽略稀盐酸的挥发).
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 氢氧化钠溶液增加的质量(g) | 0 | 13 | 24 | 32 | 31 | 41 | 43 | 44 | 44 |
(1)表中有一个时间测量的“氢氧化钠溶液增加的质量”数据是错误的,此时间是第 min;
(2)200g水垢溶于足量稀盐酸中,产生CO2的最大质量为 g;
(3)计算水垢中碳酸钙的质量分数.
(4)请在如图坐标图中用正确的数据描绘出氢氧化钠溶液增加的质量与时间的变化关系图.
(1)4;(2)44;(3)水垢中碳酸钙的质量分数为50%.
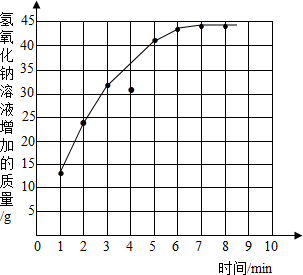
(4)
解析试题分析:(1)由于通入二氧化碳溶液的质量会不断增大,所以分析表中的数据可知第4分钟的数据存在错误;
(2)二氧化碳和氢氧化钠的反应溶液增重的质量即为反应生成的二氧化碳的质量,由于第7、8分钟的溶液增重不再变化可知该反应最终生成的二氧化碳的质量为44g;
(3)设样品中CaCO3的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 44g 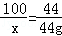
x=100
样品中CaCO3的质量分数=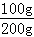 ×100%=50%
×100%=50%
(4)利用题干中的数据表格对应描点可得图象如下:水垢中碳酸钙的质量分数.
考点:根据化学反应方程式的计算.
点评:本题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
相关题目
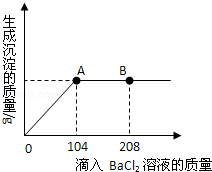
小黄同学为了测定某混合物(Na2CO3与NaOH混合)中碳酸钠的质量分数,进行了如下实验:称取了20g样品配成溶液,然后逐渐加入一定量质量分数为20.8%的BaCl2溶液(已知:Na2CO3+BaCl2=2NaCl+BaCO3↓),充分反应.在此过程中他进行了三次数据测定,结果如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 |
| 加入BaCl2溶液的质量/g | 60 | 120 | 150 |
| 生成沉淀的质量/g | 11.82 | 19.7 | 19.7 |
(1)第一次测定数据后所得溶液中含有溶质是NaOH, (填化学式);
(2)此实验中,实际参加反应的BaCl2溶液的质量为 ;
(3)样品中碳酸钠的质量分数为多少?(写出计算过程)