题目内容
(2009?衡阳)已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体试样中Ca(OH)2的质量分数为( )
【答案】分析:变质的Ca(OH)2固体试样中含有碳酸钙,能与盐酸反应生成二氧化碳,根据该反应的化学方程式求得样品中碳酸钙的质量,继而可求出该固体试样中Ca(OH)2的质量分数.
解答:解:设固体试样中碳酸钙的质量为x
CaCO3+2HCl=CaCl2 +H2O+CO2↑
100 44
x 2.2g
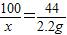
解之得:x=5g
答:固体试样中碳酸钙的质量为5g.
则该固体试样中Ca(OH)2的质量:10g-5g=5g
则该固体试样中Ca(OH)2的质量分数= 100%═50%
100%═50%
故选C
点评:此题主要考查根据化学方程式的计算及求混合物中某一物质的质量分数计算,需学生规范解题步骤,仔细审题、解答;此题能很好的培养学生的分析、解题能力.
解答:解:设固体试样中碳酸钙的质量为x
CaCO3+2HCl=CaCl2 +H2O+CO2↑
100 44
x 2.2g
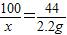
解之得:x=5g
答:固体试样中碳酸钙的质量为5g.
则该固体试样中Ca(OH)2的质量:10g-5g=5g
则该固体试样中Ca(OH)2的质量分数=
 100%═50%
100%═50%故选C
点评:此题主要考查根据化学方程式的计算及求混合物中某一物质的质量分数计算,需学生规范解题步骤,仔细审题、解答;此题能很好的培养学生的分析、解题能力.

练习册系列答案
相关题目