题目内容
【题目】为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
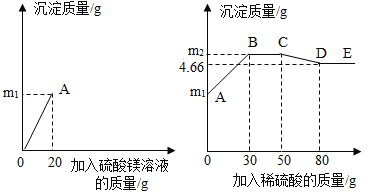
(1)滤液X的pH______7(选填“大于”、“等于”或“小于”)
(2)CD段发生反应的化学方程式为______。
(3)滤液X中含有的溶质是______。
(4)滴加入30克稀硫酸时,烧杯中沉淀的质量m2的值为多少______?(写出计算过程)
【答案】大于 Mg(OH)2+H2SO4=MgSO4+2H2O NaOH、Ba(OH)2 5.24
【解析】
(1)氢氧化钡与硫酸钠反应产生硫酸钡沉淀和氢氧化钠(显碱性)溶液,滤液X的pH大于7。
(2)CD段加入硫酸,沉淀质量减小,氢氧化镁与硫酸反应产生硫酸镁和水的化学方程式为Mg(OH)2+H2SO4=MgSO4+2H2O。
(3)滤液X中加入硫酸镁能产生大量氢氧化镁白色沉淀,继续加入稀硫酸有部分沉淀溶解,则说明氢氧化钡过量,X中含有的溶质是:氢氧化钠和氢氧化钡。
(4)设加入20g硫酸镁产生氢氧化镁的质量为x。
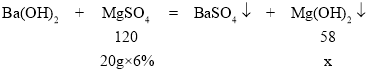
![]() ,x=0.58g
,x=0.58g
烧杯中沉淀的质量m2的值4.66g+0.58g=5.24g。

练习册系列答案
相关题目