题目内容
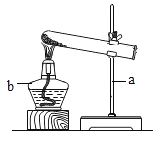
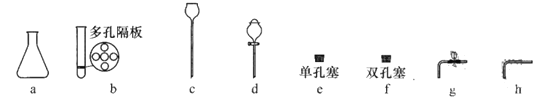
【题目】化学兴趣小组的同学欲用如图装置制取常见气体,请回答问题:
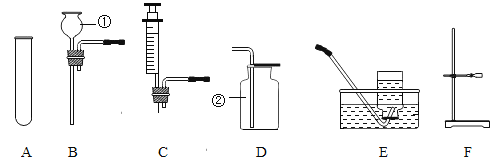
(1)写出图中有标号的仪器的名称:①____________、②______________.
(2)选用上图部分仪器和单孔橡皮塞______________(选填“能”或“不能”)完成用高锰酸钾制取氧气的实验,理由是___________________.
(3)若用A、B和F组成气体发生装置,它可以用来制取的气体有_______________(写出一种即可),该反应的化学方程式为________________.此时,若要收集干燥的气体,可选用的收集装置是______(填装置序号).
(4)已知,乙炔是一种难溶于水、密度比空气略小的气体.实验室常用块状的电石(主要成分CaC2)和水在常温下反应制取乙炔(C2H2),同时生成氢氧化钙.该反应比较剧烈,且反应放出大量的热,若操作不当,会使反应容器发生炸裂.写出实验室制取乙炔的化学方程式_______________.为了保证实验安全,你认为应该选用上述仪器中的________________(选填装置序号,下同)等仪器组成发生装置;收集时,应选用的装置是_________________.
【答案】长颈漏斗 集气瓶 不能 图中缺少酒精灯,不能加热高锰酸钾 氧气  D CaC2+2H2O=Ca(OH)2+C2H2↑ ACF E
D CaC2+2H2O=Ca(OH)2+C2H2↑ ACF E
【解析】
(1)图中标号仪器为:①长颈漏斗,②集气瓶。故答案为:长颈漏斗、集气瓶;
(2)用高锰酸钾固体制取氧气需要加热,而图中缺少酒精灯。故答案为:不能、图中缺少酒精灯,不能加热高锰酸钾;
(3)用A、B、F组成的气体发生装置属于固液混合不加热,所以可以用来制取氧气、二氧化碳、氢气等。实验室制取氧气,且不需要加热的方法是过氧化氢溶液和二氧化锰混合。其方程式为: 。若要收集干燥的氧气,需要向上排空气法。故答案为:氧气、
。若要收集干燥的氧气,需要向上排空气法。故答案为:氧气、 、D(答案合理即可);
、D(答案合理即可);
(4)根据提示和质量守恒定律可知,电石和水反应生成乙炔和氢氧化钙,则方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑。实验室中常用块状固体电石与水直接反应制取乙炔,反应比较剧烈,需要使用注射器来控制反应的速度。所以选用的发生装置为ACF。乙炔是一种无色、无味、密度比空气略小、难溶于水的气体,可以用向下排空气法和排水法收集乙炔,所以收集装置选用E。故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑、ACF、E。

 名校课堂系列答案
名校课堂系列答案【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
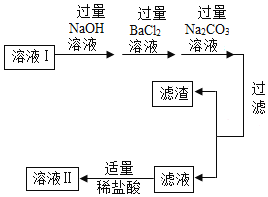
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。
【题目】实验室制备并收集二氧化碳。
①选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应),产生二氧化碳体积随时间变化曲线如下图所示:
实验编号 | 药品 |
Ⅰ | 块状大理石、10%H2SO4溶液 |
Ⅱ | 块状大理石、7%HC1溶液 |
Ⅲ | 大理石粉末、7%HC1溶液 |
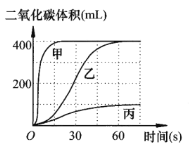
图中丙对应实验______(选填“I”“Ⅱ”或“Ⅲ”)。确定用乙对应的药品制备并收集二氧化碳,相应的化学方程式是 ________;不用甲对应的药品,理由是 ________ 。搭建装置。
②组装简易启普发生器,应选用________(选填编号)。
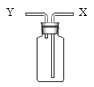
③收集二氧化碳。用下图装置收集时,空气从 _________ (选填“x”或“y”)端排出。
④检验二氧化碳。写出检验时反应的化学方程式。 ___________