题目内容
以石灰石、赤铁矿为原料,进行金属铁的冶炼,各物质之间的转化关系如下图所示.
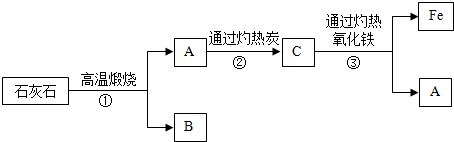
试回答:
Ⅰ.写出步骤①和③的化学方程式:① 、③ .
Ⅱ.上述流程中可循环利用的物质是 (填物质名称).
Ⅲ.B中还含有未煅烧完的碳酸钙.检验方法Ⅰ:取样, ,证明B残渣中含有碳酸钙;检验方法Ⅱ: ,证明B残渣中含有碳酸钙.

试回答:
Ⅰ.写出步骤①和③的化学方程式:①
Ⅱ.上述流程中可循环利用的物质是
Ⅲ.B中还含有未煅烧完的碳酸钙.检验方法Ⅰ:取样,
分析:Ⅰ、石灰石高温分解生成氧化钙和二氧化碳,化学方程式为CaCO3
CaO+CO2↑;二氧化碳与碳反应生成一氧化碳,一氧化碳能与氧化铁反应生成铁和二氧化碳,故A为二氧化碳,B为氧化钙,C为一氧化碳,一氧化碳与氧化铁反应生成二氧化碳和铁,化学方程式为Fe2O3+3CO
2Fe+3CO2
Ⅱ、在整个过程中二氧化碳可循环利用.
Ⅲ、根据碳酸钙的化学性质分析,碳酸钙能与盐酸反应生成二氧化碳,还能高温分解生成二氧化碳.
| ||
| ||
Ⅱ、在整个过程中二氧化碳可循环利用.
Ⅲ、根据碳酸钙的化学性质分析,碳酸钙能与盐酸反应生成二氧化碳,还能高温分解生成二氧化碳.
解答:解:Ⅰ、石灰石高温分解生成氧化钙和二氧化碳,化学方程式为CaCO3
CaO+CO2↑;二氧化碳与碳反应生成一氧化碳,一氧化碳能与氧化铁反应生成铁和二氧化碳,故A为二氧化碳,B为氧化钙,C为一氧化碳,一氧化碳与氧化铁反应生成二氧化碳和铁,化学方程式为Fe2O3+3CO
2Fe+3CO2
Ⅱ、由上述分析可知二氧化碳可以循环利用.
Ⅲ、Ⅰ碳酸钙能与盐酸反应生成二氧化碳,因此检验B中还含有未煅烧完的碳酸钙可以取样品少量于试管,滴加稀盐酸,有气泡产生,证明B残渣中含有碳酸钙;Ⅱ、碳酸钙在高温条件下能分解生成氧化钙和二氧化碳,因此可取样,将样品称量:m1克,将样品高温煅烧,冷却后再称量:m2克,若m1>m2证明B残渣中含有碳酸钙.
故答案为:ⅠCaCO3
CaO+CO2↑
Fe2O3+3CO
2Fe+3CO2
Ⅱ二氧化碳
Ⅲ滴加稀盐酸,有气泡产生
取样,将样品称量:m1克,将样品高温煅烧,冷却后再称量:m2克,若m1>m2
| ||
| ||
Ⅱ、由上述分析可知二氧化碳可以循环利用.
Ⅲ、Ⅰ碳酸钙能与盐酸反应生成二氧化碳,因此检验B中还含有未煅烧完的碳酸钙可以取样品少量于试管,滴加稀盐酸,有气泡产生,证明B残渣中含有碳酸钙;Ⅱ、碳酸钙在高温条件下能分解生成氧化钙和二氧化碳,因此可取样,将样品称量:m1克,将样品高温煅烧,冷却后再称量:m2克,若m1>m2证明B残渣中含有碳酸钙.
故答案为:ⅠCaCO3
| ||
Fe2O3+3CO
| ||
Ⅱ二氧化碳
Ⅲ滴加稀盐酸,有气泡产生
取样,将样品称量:m1克,将样品高温煅烧,冷却后再称量:m2克,若m1>m2
点评:根据反应过程确定物质的成分及根据碳酸钙的性质确定检验方法是解答本题关键.

练习册系列答案
相关题目
 工业上以石灰石和赤铁矿为主要原料可以制取B和G,其转化
工业上以石灰石和赤铁矿为主要原料可以制取B和G,其转化
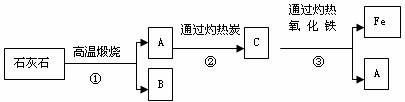
 。
。 ,证明B残渣中含有碳酸钙;检验方法Ⅱ:
,证明B残渣中含有碳酸钙;检验方法Ⅱ:
 。
。