题目内容
【题目】某化学兴趣小组的同学取氢氧化钠和碳酸钠的混合溶液50g装入烧杯中,每次滴加50g稀盐酸充分反应。测得部分数据及图像如下:
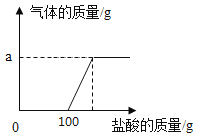
次数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸的质量/g | 50 | 50 | 50 | 50 | 50 |
烧杯中物质的质量/g | 100 | 150 | 197.8 | 245.6 | 295.6 |
请根据有关信息计算:
(1)a的数值为________。
(2)稀盐酸中溶质的质量分数为_____。(写出计算过程)
(3)恰好完全反应后所得溶液中溶质的质量为_____。(写出计算过程)
【答案】4.4 7.3% 23.4g
【解析】
根据质量守恒定律可知,反应前后质量的减少是因为生成了二氧化碳,可以先求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算所用盐酸溶液溶质的质量分数,再求出反应生成的溶质氯化钠的质量。
(1)由上分析可知a=50g+(5×50g)-295.6g=4.4g;(2)由题表可知第一次和第二次所加稀盐酸质量恰好和氢氧化钠完全反应,第三次所加稀盐酸和碳酸钠反应,生成二氧化碳质量为(3×50g)+50g-197.8g=2.2g,第四次所加盐酸和碳酸钠反应,生成二氧化碳质量为(4×50g)+50g-245.6g=2.2g,第五次加入稀盐酸的质量没有变化,即245.6g +50g=295.6g,说明第四次加入的稀盐酸恰好反应完毕,第五次加入的稀盐酸不参加反应,即和碳酸钠反应的稀盐酸的质量为50g+50g=100g,设和碳酸钠反应的100g稀盐酸中溶质质量为x,生成的氯化钠质量为y,
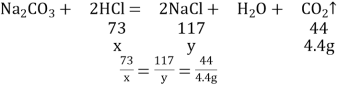
解得x=7.3g,y=11.7g,
稀盐酸中溶质质量分数为![]() =7.3%;
=7.3%;
(3)设氢氧化钠和稀盐酸反应生成的氯化钠质量为z,

解得z=11.7g,
恰好完全反应后溶液中的溶质氯化钠质量为两部分,一部分是碳酸钠和稀盐酸反应生成的氯化钠(11.7g),一部分是氢氧化钠和稀盐酸反应生成的氯化钠(11.7g),即恰好完全反应后溶液中的溶质氯化钠质量为11.7g+11.7g=23.4g;
答:(1)a的数值为4.4g;(2)稀盐酸中溶质的质量分数为7.3%;(3)恰好完全反应后所得溶液中溶质的质量为23.4g。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】我国自主设计的大型客机成功试飞,国产航母下水,标志着我国的金属材料制造技术取得重大突破。根据所学知识回答下列问题:
金属 | A | B | C | D |
导电性(以100为标准) | 99 | 61 | 17 | 7.9 |
密度/(g﹒cm-3) | 8.92 | 2.70 | 7.86 | 11.3 |
熔点/°C | 1083 | 660 | 1535 | 327 |
硬度(以10为标准) | 3 | 2.7 | 5 | 1.5 |
(1)常温下一些金属的物理性质数据如表,据此可知高压输电线最好选用金属_____(填字母);C的合金通常可以做菜刀、锤子等,其合金的硬度_____5(填“>”“<”或“=”)。
(2)铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等,写出磁铁矿的主要成分与一氧化碳反应的化学方程式_____。
(3)某兴趣小组为探究Zn、Fe、Cu、Ag四种金属的活动性,进行如下图中甲、乙、丙三个实验。
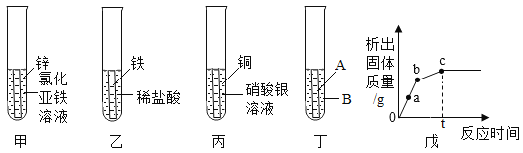
①小组同学随后发现该实验无法得出四种金属的活动性顺序。于是补充图丁实验,最终得出四种金属活动性:Zn>Fe>Cu>Ag,则图丁中的试剂A、B分别为_____(写出一组即可)。
③小组同学将丙试管中的物质过滤后、向滤液中加入甲中剩余的锌,析出固体质量的变化随反应时间的关系如戊图所示。写出a点对应溶液中所含的溶质是_____(填化学式)。