题目内容
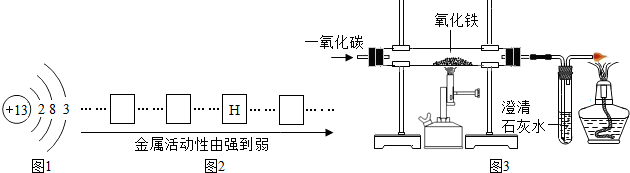
实验室中石灰水通常放在 中,向试管中倒入石灰水时,标签应向 .用酒精灯给物质加热时,应用酒精灯火焰的 部分.
【答案】分析:根据药品有盛放、取用及酒精灯使用分析解答.液体盛在细口瓶里,倒液体时,标签应向手心,酒精灯加热时应用外焰,外焰温度最高
解答:解:实验室中石灰水通常放在细口瓶中,向试管中倒入石灰水时,标签应向 手心.防止药液流下来腐蚀标签.用酒精灯给物质加热时,应用酒精灯火焰的 外焰部分.外焰温度最高.
故答案为:细口瓶;手心;外焰.
点评:记住药品的存放、取用及酒精灯的使用是解答本题关健.
解答:解:实验室中石灰水通常放在细口瓶中,向试管中倒入石灰水时,标签应向 手心.防止药液流下来腐蚀标签.用酒精灯给物质加热时,应用酒精灯火焰的 外焰部分.外焰温度最高.
故答案为:细口瓶;手心;外焰.
点评:记住药品的存放、取用及酒精灯的使用是解答本题关健.

练习册系列答案
相关题目
下列是初三某合作学习小组实验室制取二氧化碳气体的研究过程,请你参与其中.
(一)在实验制取过程中,请回答下列问题:
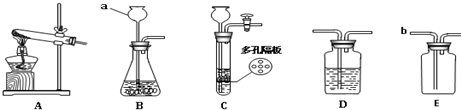
(1)如图中烧瓶内放的药品是大理石或 (填名称);
(2)实验室制取二氧化碳的文字表达式为是 ;
(3)小兵同学在用此装置制取并验证二氧化碳的性质时,在烧瓶内装入固体药品,在分液漏斗内加入稀盐酸,打开分液漏斗的活塞,发现分液漏斗内液体不能滴下,可能的原因是 .
(4)小兵同学用排水法收集与排空气法收集CO2的进行比较(分别用体积相同的2个集气瓶收集),请帮他完成下表.
(二)实验室制取二氧化碳通常不选用大理石与稀硫酸反应,其原因是反应生成的硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止.为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
实验一 选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
实验二 选择合适的反应温度
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
请根据本次活动的研究目的,分析处理以上两个表中数据,得出结论:
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为 %.
(2)在合适的硫酸浓度下,应选择最合适的反应温度为 ℃.
(3)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加 操作,更有利于气体的制备.
(4)你认为该研究小组还可以研究 对该反应速率的影响.

(一)在实验制取过程中,请回答下列问题:
(1)如图中烧瓶内放的药品是大理石或 (填名称);
(2)实验室制取二氧化碳的文字表达式为是 ;
(3)小兵同学在用此装置制取并验证二氧化碳的性质时,在烧瓶内装入固体药品,在分液漏斗内加入稀盐酸,打开分液漏斗的活塞,发现分液漏斗内液体不能滴下,可能的原因是 .
(4)小兵同学用排水法收集与排空气法收集CO2的进行比较(分别用体积相同的2个集气瓶收集),请帮他完成下表.
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速率远大于其溶解和与水反应的速率 | CO2密度比空气大,且 . |
| 收集过程分析 | 集满现象: . | “验满”分析:因气体无色,故集满与否较难确定.即便用燃着木条移近容器口火焰熄灭,也难以证明空气完全排尽. |
| 向收集到的CO2集气瓶内倒入等体积适量澄清石灰水,并振荡 | 先浑浊后变澄清所需时间较短. | 先浑浊后变澄清所需时间较长. |
| 由上述实验可得结论 | ① ;② . | |
实验一 选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有1g直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
| 试管编号 | 1 | 2 | 3 | 4 | 5 |
| 硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
| 气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
操作:往盛有1g直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
| 试管编号 | A | B | C | D | E |
| 温度(℃) | 40 | 50 | 60 | 70 | 80 |
| 现象和 比较 | 有少量气泡 | 气泡比A号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
(1)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为 %.
(2)在合适的硫酸浓度下,应选择最合适的反应温度为 ℃.
(3)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加 操作,更有利于气体的制备.
(4)你认为该研究小组还可以研究 对该反应速率的影响.

 下列是初三某合作学习小组实验室制取二氧化碳气体的研究过程,请你参与其中.
下列是初三某合作学习小组实验室制取二氧化碳气体的研究过程,请你参与其中. 下列是初三某合作学习小组实验室制取二氧化碳气体
下列是初三某合作学习小组实验室制取二氧化碳气体