题目内容
 (2012?东营)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.
(2012?东营)某兴趣小组对生锈废铁锅中铁的含量进行了测定.生锈的铁锅中除Fe、Fe2O3外,还含有碳、硅、锰等元素(除Fe、Fe2O3以外的物质都不与稀硫酸反应).兴趣小组的同学称取33g废铁锅片放入特制容器中,缓慢加入39.2%的稀硫酸,直到反应完全(假设硫酸先与表面的铁锈发生反应),实验数据如图所示.(1)从化学元素与人体健康的角度考虑,我们应选用铁锅还是铝锅
铁锅
铁锅
,因为铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害
铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害
.(2)废铁锅片中铁单质的质量分数为
84.8%
84.8%
.(结果保留到0.1%)(3)所得溶液中所含溶质的化学式为
Fe2(SO4)3、FeSO4
Fe2(SO4)3、FeSO4
,计算溶液中硫酸铁的质量.(要求写出计算过程)分析:(1)铝元素有毒,对人体有害,而铁是人体必需额微量元素,可以据此解答;
(2)根据生成气体的质量可以求算出铁的质量,进而求算出铁的质量分数;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;分析图中坐标系可以知道氧化铁消耗硫酸的质量为18.75g,可以据此求算出硫酸铁的质量.
(2)根据生成气体的质量可以求算出铁的质量,进而求算出铁的质量分数;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;分析图中坐标系可以知道氧化铁消耗硫酸的质量为18.75g,可以据此求算出硫酸铁的质量.
解答:解:(1)铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害,所以从化学元素与人体健康的角度考虑,我们应选用铁锅;
(2)设废铁锅片中铁单质的质量为x
Fe+H2SO4 =FeSO4+H2↑
56 2
x 1.0g
=
解得:x=28g
废铁锅片中铁单质的质量分数为:
×100%=84.8%;
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;所以在反应后的溶液中含有的溶质为:Fe2(SO4)3、FeSO4;
根据图中信息可以知道,和氧化铁反应的硫酸的质量为:18.75g×39.2%=7.35g;
设生成Fe2(SO4)3的质量为y
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
294 400
7.35g y
=
解得:y=10g
答:溶液中硫酸铁的质量为10g.
故答案为:(1)铁锅;铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害;
(2)84.8%;
(3)Fe2(SO4)3、FeSO4;10g.
(2)设废铁锅片中铁单质的质量为x
Fe+H2SO4 =FeSO4+H2↑
56 2
x 1.0g
| 56 |
| x |
| 2 |
| 1.0g |
解得:x=28g
废铁锅片中铁单质的质量分数为:
| 28g |
| 33g |
(3)铁锈的主要成分为氧化铁,氧化铁和铁都能和稀硫酸反应,铁和硫酸反应生成硫酸亚铁,而氧化铁和硫酸反应生成硫酸铁;所以在反应后的溶液中含有的溶质为:Fe2(SO4)3、FeSO4;
根据图中信息可以知道,和氧化铁反应的硫酸的质量为:18.75g×39.2%=7.35g;
设生成Fe2(SO4)3的质量为y
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
294 400
7.35g y
| 294 |
| 400 |
| 7.35g |
| y |
解得:y=10g
答:溶液中硫酸铁的质量为10g.
故答案为:(1)铁锅;铁是人体必需的微量元素,而铝是不必需元素,而且铝元素对人体有害;
(2)84.8%;
(3)Fe2(SO4)3、FeSO4;10g.
点评:要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
相关题目
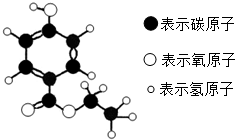 (2012?东营)如图为某有机物的分子模型,该有机物是一种高效食品防腐剂.下列说法不正确的是( )
(2012?东营)如图为某有机物的分子模型,该有机物是一种高效食品防腐剂.下列说法不正确的是( ) (2012?东营)东营市计划用5年时间,布局建设30处生态林场,实现城市森林环抱、沿海碧水绿树的目标.为保证新植树木的成活率,树上还挂了吊瓶袋(如图).某课外活动小组想对吊瓶袋内液体成分进行探究,察看吊瓶袋的说明很简单,没有具体的成分,但他们判断肯定是一种植物营养液,并上网查得下列两份资料:
(2012?东营)东营市计划用5年时间,布局建设30处生态林场,实现城市森林环抱、沿海碧水绿树的目标.为保证新植树木的成活率,树上还挂了吊瓶袋(如图).某课外活动小组想对吊瓶袋内液体成分进行探究,察看吊瓶袋的说明很简单,没有具体的成分,但他们判断肯定是一种植物营养液,并上网查得下列两份资料: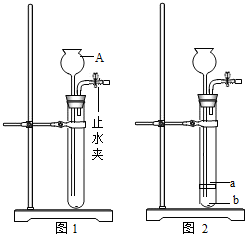 (2012?东营)实验室制取O2或CO2气体的发生装置如图1,请回答下列问题:
(2012?东营)实验室制取O2或CO2气体的发生装置如图1,请回答下列问题: