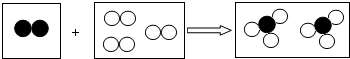
题目内容
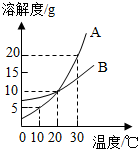 (2013?金华)如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )
(2013?金华)如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )分析:A、根据30℃时,A物质的溶解度进行分析;B、根据A物质的饱和溶液从30℃降温到10℃,溶解度减小,会析出晶体考虑;C、根据B物质的饱和溶液从30℃降温到20℃,会析出晶体,溶质减少进行分析;D、根据不饱和溶液与饱和溶液的转化方法考虑;
解答:解:A、30℃时,A物质的溶解度是20g,是在30℃时,100g水中最多溶解20gA物质,所以30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液,还有5g溶质没有溶解,故A说法正确;
B、A物质的饱和溶液从30℃降温到10℃,溶解度减小,会析出晶体,仍然是饱和溶液,故B说法错误;
C、B物质的饱和溶液从30℃降温到20℃,会析出晶体,溶质减少,溶剂不变,溶质质量分数减少,故C说法正确;
D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂、加入溶质、降低温度等方法,故D说法正确.
故选B.
B、A物质的饱和溶液从30℃降温到10℃,溶解度减小,会析出晶体,仍然是饱和溶液,故B说法错误;
C、B物质的饱和溶液从30℃降温到20℃,会析出晶体,溶质减少,溶剂不变,溶质质量分数减少,故C说法正确;
D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂、加入溶质、降低温度等方法,故D说法正确.
故选B.
点评:解答本题关键是要知道饱和溶液的判断,在某一温度,一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,不管是升温还是降温,只要是溶解度见小了,就会析出晶体.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 ”、“
”、“ ”分别表示不同元素的原子,下列对图示模型理解正确的是( )
”分别表示不同元素的原子,下列对图示模型理解正确的是( )