题目内容
已知Zn、Mg、Fe、Al和稀硫酸反应的化学方程式分别是Zn+H2SO4═ZnSO4+H2↑、Mg+H2SO4═MgSO4+H2↑、Fe+H2SO4═FeSO4+H2↑、2Al+3H2SO4═Al2(SO4)3+3H2↑,则相同质量的Zn、Mg、Fe、Al分别和稀硫酸反应,产生氢气的质量由大到小的顺序是________.
Al>Mg>Fe>Zn
分析:由金属活动性顺序可知反应速率快慢与金属活动性顺序有关,产生氢气的多少需根据化学方程式进行计算.
解答:假设金属为一能够反应且化合价为+2价的金属M,其相对原子质量为x,金属的质量为m,生成的氢气的质量为y.
M+H2SO4═MSO4+H2↑
x 2
m y
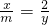
解:y= ,通过这个式子可以看出,当等质量的金属完全反应时,生成的氢气的质量与金属的相对原子质量成反比,相对原子质量越大,生成的氢气的质量也就越小.
,通过这个式子可以看出,当等质量的金属完全反应时,生成的氢气的质量与金属的相对原子质量成反比,相对原子质量越大,生成的氢气的质量也就越小.
铝在形成化合物时的化合价为+3,所以为了达到统一的标准可以将铝元素的化合价转化为:+3×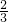 =+2,所以其相对分子质量也可以变为:27×
=+2,所以其相对分子质量也可以变为:27×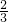 =18,而Mg、Fe、Zn的相对原子质量分别为24、56、65,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.
=18,而Mg、Fe、Zn的相对原子质量分别为24、56、65,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.
故答案为:Al>Mg>Fe>Zn.
点评:本题考查了金属与酸反应产生氢气质量的关系,完成此题,可以依据已有的知识.所以要求同学们在平时的学习中加强基础知识的记忆和理解,以便能够灵活应用.
分析:由金属活动性顺序可知反应速率快慢与金属活动性顺序有关,产生氢气的多少需根据化学方程式进行计算.
解答:假设金属为一能够反应且化合价为+2价的金属M,其相对原子质量为x,金属的质量为m,生成的氢气的质量为y.
M+H2SO4═MSO4+H2↑
x 2
m y
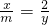
解:y=
 ,通过这个式子可以看出,当等质量的金属完全反应时,生成的氢气的质量与金属的相对原子质量成反比,相对原子质量越大,生成的氢气的质量也就越小.
,通过这个式子可以看出,当等质量的金属完全反应时,生成的氢气的质量与金属的相对原子质量成反比,相对原子质量越大,生成的氢气的质量也就越小.铝在形成化合物时的化合价为+3,所以为了达到统一的标准可以将铝元素的化合价转化为:+3×
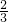 =+2,所以其相对分子质量也可以变为:27×
=+2,所以其相对分子质量也可以变为:27×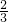 =18,而Mg、Fe、Zn的相对原子质量分别为24、56、65,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.
=18,而Mg、Fe、Zn的相对原子质量分别为24、56、65,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.故答案为:Al>Mg>Fe>Zn.
点评:本题考查了金属与酸反应产生氢气质量的关系,完成此题,可以依据已有的知识.所以要求同学们在平时的学习中加强基础知识的记忆和理解,以便能够灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目